题目内容
7.铅蓄电池的两极分别是Pb、PbO2,电解质溶液为稀硫酸,放电时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列有关叙述正确的是( )| A. | 铅为负极被还原 | B. | 电解质溶液密度不断减小 | ||
| C. | SO42-只向PbO2极移动 | D. | 溶液的pH不断减小 |
分析 根据电池反应式知,放电时,铅失电子发生氧化反应而作负极,电极反应式为Pb-2e-+SO42-=PbSO4,二氧化铅得电子作正极,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,电解质溶液中阳离子向正极移动,阴离子向负极移动,结合电极方程式解答该题.
解答 解:A.由总反应式可知Pb化合价升高,被氧化,应为原电池负极,故A错误;
B.电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,生成水,密度减小,故B正确;
C.阴离子向负极移动,即向Pb移动,故C错误;
D.由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,硫酸被消耗,所以酸性减弱,pH不断增大,故D错误.
故选B.
点评 本题考查了原电池原理,侧重于学生的分析能力的考查,为高频考点,注意根据元素化合价变化确定正负极,再结合阴阳离子的移动方向、氢离子浓度的变化来分析解答,难度中等.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
17.物质是电解质物质,熔融态却不导电,溶于水时化学键被破坏的是( )
| A. | 液溴 | B. | 氯化氢 | C. | 蔗糖 | D. | 硫酸钡 |
15.下列四组实验,根据实验事实得出的结论,正确的是( )
| A. | 在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体--原未知试液中一定含有NH4+ | |
| B. | 在某未知试液中加入硝酸银溶液,产生白色沉淀--原未知试液中一定含有Cl- | |
| C. | 用洁净的铂丝蘸取某溶液,置于火焰上灼烧,观察到火焰呈黄色--原溶液中一定含有Na+,不含有K+ | |
| D. | 在某未知试液中滴加过量的稀盐酸得到澄清溶液,再往澄清溶液中加入BaCl2溶液得白色沉淀--原未知试液中一定含有SO42- |
2.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持设备已省略).
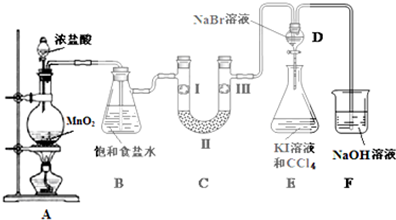
已知:浓硫酸、碱石灰和无水氯化钙均具有吸水性,碱石灰是生石灰和氢氧化钠的混合物.请回答下列问题:
(1)装置A中盛装浓盐酸的仪器名称为分液漏斗,往圆底烧瓶中滴加浓盐酸,反应开始后,圆底烧瓶中发生反应的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填字母)
(4)当向装置D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙色,
装置D中发生反应的离子方程式为2Br-+Cl2=Br2+2Cl-.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是装置E中的溶液分为两层,下层(CCl4层)为紫红色.
(6)装置F中NaOH溶液的作用是吸收多余的氯气,防止污染空气.

已知:浓硫酸、碱石灰和无水氯化钙均具有吸水性,碱石灰是生石灰和氢氧化钠的混合物.请回答下列问题:
(1)装置A中盛装浓盐酸的仪器名称为分液漏斗,往圆底烧瓶中滴加浓盐酸,反应开始后,圆底烧瓶中发生反应的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填字母)
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
装置D中发生反应的离子方程式为2Br-+Cl2=Br2+2Cl-.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是装置E中的溶液分为两层,下层(CCl4层)为紫红色.
(6)装置F中NaOH溶液的作用是吸收多余的氯气,防止污染空气.
19.推理是一种重要的学习和研究方法.下列推理正确的是( )
| A. | 单质中只含一种元素,所以只含一种元素的物质一定是单质 | |
| B. | 化学变化前后物质的质量总和不变,所以1g H2和1g O2一定能够生成2g H2O | |
| C. | 碱性溶液能使酚酞溶液变红,所以能使酚酞溶液变红的物质一定呈碱性 | |
| D. | 中和反应有盐和水生成,所以有盐和水生的反应一定是中和反应 |
20.下列无色溶液中,离子可大量共存的是( )
| A. | Cu2+、K+、OH-、CO32- | B. | H+、Ba2+、SO32-、Br - | ||
| C. | K+、Na+、Cl-、MnO4- | D. | Ca2+、Na+、HCO3-、I- |
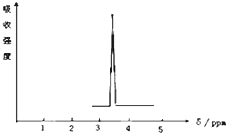 在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目
在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目