题目内容
13.如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.反应①常被应用于野外焊接钢轨,A是一种常见金属,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液.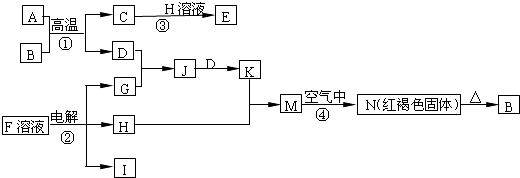
请回答下列问题:
(1)B的化学式为Fe2O3.
(2)F的电子式
 .
.(3)写出反应③的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)写出反应④的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,A为常见金属,则A为Al,B为Fe2O3,F是海水中含有盐的主要成分,则F为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,E为NaAlO2,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2,结合物质的性质解答该题.
解答 解:反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,A为常见金属,则A为Al,B为Fe2O3,F是海水中含有盐的主要成分,则F为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,E为NaAlO2,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2.
(1)由以上分析可知B为Fe2O3,故答案为:Fe2O3;
(2)F为NaCl,电子式为 ,故答案为:
,故答案为: ;
;
(3)反应③为Al2O3和NaOH的反应,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)反应④为氢氧化亚铁氧化生成氢氧化铁,反应化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物的推断,题目难度中等,物质的颜色、反应①的液态、F为海水中盐主要成分等是推断突破口.

练习册系列答案
相关题目
4.下列各组离子在指定的溶液中能大量共存的是( )
| A. | 无色溶液中:K+、Cu2+、Na+、SO42- | |
| B. | 在由水电离出的c(OH-)=10-13 mol•L-1的溶液中:Na+、Ba2+、Cl-、I- | |
| C. | 能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO- | |
| D. | 含有大量ClO-的溶液:H+、I-、SO42-、Cl- |
8.下列化学用语正确的是( )
| A. | S原子的结构示意图: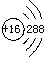 | |
| B. | 氯化钠的电子式: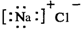 | |
| C. | 乙醇的结构式: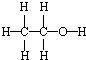 | |
| D. | 硫酸的电离方程式:HSO4=H2++SO42- |
5.下列各项中的物质能导电且属于强电解质的是( )
| A. | 氯化钠晶体 | B. | 熔融状态的氯化镁 | ||
| C. | 氨水 | D. | 醋酸 |
2.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持设备已省略).
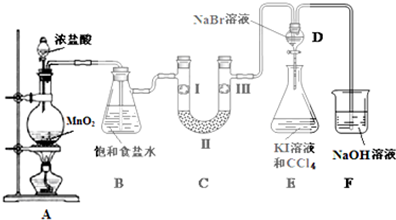
已知:浓硫酸、碱石灰和无水氯化钙均具有吸水性,碱石灰是生石灰和氢氧化钠的混合物.请回答下列问题:
(1)装置A中盛装浓盐酸的仪器名称为分液漏斗,往圆底烧瓶中滴加浓盐酸,反应开始后,圆底烧瓶中发生反应的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填字母)
(4)当向装置D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙色,
装置D中发生反应的离子方程式为2Br-+Cl2=Br2+2Cl-.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是装置E中的溶液分为两层,下层(CCl4层)为紫红色.
(6)装置F中NaOH溶液的作用是吸收多余的氯气,防止污染空气.

已知:浓硫酸、碱石灰和无水氯化钙均具有吸水性,碱石灰是生石灰和氢氧化钠的混合物.请回答下列问题:
(1)装置A中盛装浓盐酸的仪器名称为分液漏斗,往圆底烧瓶中滴加浓盐酸,反应开始后,圆底烧瓶中发生反应的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填字母)
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
装置D中发生反应的离子方程式为2Br-+Cl2=Br2+2Cl-.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是装置E中的溶液分为两层,下层(CCl4层)为紫红色.
(6)装置F中NaOH溶液的作用是吸收多余的氯气,防止污染空气.