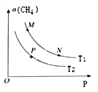
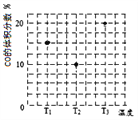
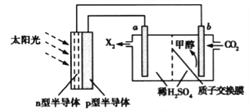
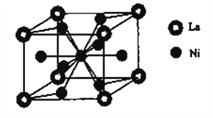
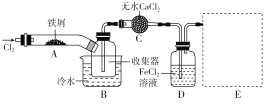
题目内容
【题目】铝是一种重要的金属。
(1)铝在元素周期表中的位置是_______________________________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为____________。铝热反应也可以用于金属的冶炼,有同学认为将氧化镁和铝分放一起在高温下可用于镁的冶炼,你认为此说法________(填对或不对),认为不对的请说出原因____________________________并写出镁的冶炼的化学方程式 ________________________________________(认为对的此项可不作答)。
(3)铝与NaOH溶液反应的离子方程式为_____________________;
(4)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括①________,②冷却结晶,③过滤。在第①步操作中应注意的事项是__________________。
(5).加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,此操作应注意在___________ ,其原因是(结合化学方程式简要说明)______________。
【答案】 第3周期ⅢA族 2Al+Fe2O3![]() Al2O3+2Fe 不对 镁的活动性比铝的强 MgCl2(熔融)
Al2O3+2Fe 不对 镁的活动性比铝的强 MgCl2(熔融) ![]() Mg+Cl2↑ 2Al+2OH-+2H2O===2AlO+3H2↑ 加热浓缩 用玻璃棒不断搅拌溶液,当有晶体析出时停止加热 因存在AlCl3+3H2O
Mg+Cl2↑ 2Al+2OH-+2H2O===2AlO+3H2↑ 加热浓缩 用玻璃棒不断搅拌溶液,当有晶体析出时停止加热 因存在AlCl3+3H2O![]() Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3
Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3
【解析】本题主要考查铝及其化合物的性质。
(1)铝在元素周期表中的位置是第3周期ⅢA族。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。铝热反应也可以用于金属的冶炼,有同学认为将氧化镁和铝分放一起在高温下可用于镁的冶炼,此说法不对,因为镁的活动性比铝的强。镁的冶炼的化学方程式为MgCl2(熔融)
Al2O3+2Fe。铝热反应也可以用于金属的冶炼,有同学认为将氧化镁和铝分放一起在高温下可用于镁的冶炼,此说法不对,因为镁的活动性比铝的强。镁的冶炼的化学方程式为MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。
(3)铝与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑;
(4)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括①加热浓缩,②冷却结晶,③过滤。在第①步操作中应注意的事项是用玻璃棒不断搅拌溶液,当有晶体析出时停止加热,防止晶体受热分解。
(5).加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,此操作应注意在在干燥的HCl气流中进行,其原因是AlCl3+3H2O![]() Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3。
Al(OH)3+3HCl,在干燥的HCl气流中,能抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,可得到纯净的AlCl3。