题目内容
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化:CH4(g)+ ![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
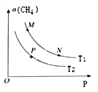
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_________。
②M、N两点的H2的物质的量浓度c(M)______c(N)(填“>”“<”或“=”)。
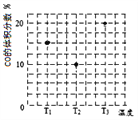
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g)![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
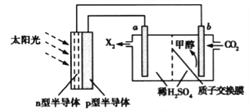
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为___________________;当电路中有3mol电子转移时,质子交换膜两侧溶液相差_________g。
【答案】 高温 +247.1 > 反应①为放热反应,温度升高,平衡逆向移动,CH4(g)的平衡转化率降低,所以T1<T2,故P点平衡常数小于N点 < T3 9V2/2a2 CO2+6e﹣+6H+=CH3OH+H2O 52
【解析】(1)本题考查自发反应的判断和盖斯定律的应用,根据符合判据,△G=△H-T△S,自发进行要求△G<0,根据②反应,此反应是吸热反应,即△H>0,反应前气体的系数和小于反应后气体系数和,此反应是熵增,即△S>0, 此反应自发进行的条件是高温,根据盖斯定律,②-③得出△H4=(205.9+41.2)kJ·mol-1=+247.1kJ·mol-1;(2)考查化学平衡常数、影响化学平衡常数的因素、勒夏特列原理,反应①是放热反应,作等压线,升高温度,甲烷的转化率降低,即T2>T1,化学平衡常数只受温度的影响,因此根据化学平衡常数的定义,推出K(N)>K(P); ②N点的压强大于M点,依据勒夏特列原理,增大压强,平衡向体积减小的方向移动,针对反应①,增大压强平衡虽然向逆反应方向移动,但平衡移动的趋势微弱,组分浓度增大,即氢气的浓度c(M)<c(N);(3)本题考查化学平衡状态的判断、化学平衡常数的计算,随着反应的进行,CO的体积分数应是降低,当达到平衡,升高温度,平衡向逆反应方向进行,CO的体积分数增大,即T3达到平衡,T2不知道是不是最低点,无法确定是否达到平衡;CO(g) +2H2(g)![]() CH3OH(g)
CH3OH(g)
起始物质的量:a 2a 0
变化: x 2x x
平衡: a-x 2(a-x) x 根据图像,因此有(a-x)/(3a-2x)×100%=20%,解得x=2a/3,根据平衡常数的表达式,K= 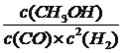 ,代入数值,解得K=9V2/2a2;(4)本题考查电极反应式的书写和电化学计算,根据工作原理,b极上生成甲醇,且此装置的环境是酸性,因此b电极反应式为CO2+6e﹣+6H+=CH3OH+H2O,a极反应式为2H2O-4e-=O2↑+4H+,b极溶液增加CO2和H+量,a极溶液减少O2和H+的量,当电路中有3mol电子转移,b极增加了1/2molCO2和3molH+,即质量增加为(22+3)g=25g,a极减少3/4molO2,为了平衡b极阴离子,需要从a电极向b电极移动3molH+,即b极质量减少(24g+3g)=27g,因此两极溶液质量相差(27+25)g=52g。
,代入数值,解得K=9V2/2a2;(4)本题考查电极反应式的书写和电化学计算,根据工作原理,b极上生成甲醇,且此装置的环境是酸性,因此b电极反应式为CO2+6e﹣+6H+=CH3OH+H2O,a极反应式为2H2O-4e-=O2↑+4H+,b极溶液增加CO2和H+量,a极溶液减少O2和H+的量,当电路中有3mol电子转移,b极增加了1/2molCO2和3molH+,即质量增加为(22+3)g=25g,a极减少3/4molO2,为了平衡b极阴离子,需要从a电极向b电极移动3molH+,即b极质量减少(24g+3g)=27g,因此两极溶液质量相差(27+25)g=52g。