��Ŀ����
����Ŀ�����Ļ������ڹ�ҵ������Ҫ��Ӧ�ã�
��1��FeCl3��ˮ��ԭ���ǣ������ӷ���ʽ��ʾ��_________________��FeCl3��Һ��ʴ�����豸����H+�����⣬��һ��Ҫԭ���ǣ������ӷ���ʽ��ʾ��________________��
��2��Ϊ��Լ�ɱ�����ҵ����NaClO3 ��������FeCl2��Һ�õ�FeCl3��
��������FeCl2��Һ��c��Fe2+��=2.0��10��2molL��1��c��Fe3+��=1.0��10��3molL��1��c��Cl����=5.3��10��2molL��1�������Һ��PHԼΪ_____��
�����NaClO3 ����FeCl2 �����ӷ���ʽ��
��ClO3�� +___Fe2+ +___ ____= __Cl�� + ___Fe3++ __ ____��
��3��������أ�K2FeO4����һ�����͡���Ч�����ˮ���������Ҳ�����ɶ�����Ⱦ����֪�����������ȶ��Բ��ҵ����ʪ���Ʊ�K2FeO4��������ͼ1��ʾ����Ӧ�ۼ���ŨKOH��Һ������������أ�K2FeO4������˵��__________________________��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ��õ�NaCl��NaClO��NaClO3�Ļ����Һ�����ⶨClO����ClO3�����ӵ����ʵ���֮����1��2����Cl2���������Ʒ�Ӧʱ������ԭ����Ԫ�غͱ���������Ԫ�ص����ʵ���֮��Ϊ_____��
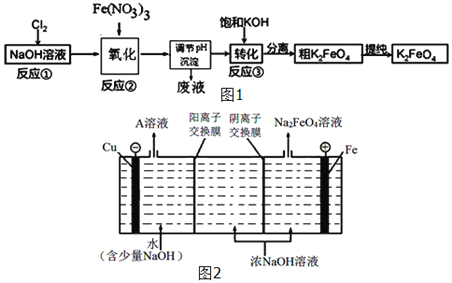
��4����ҵ�ϻ�����ͨ�����ŨNaOH��Һ���Ʊ�Na2FeO4���乤��ԭ����ͼ2��ʾ�������ĵ缫��ӦʽΪ__________________________��
���𰸡� Fe3++3H2O![]() Fe��OH��3��������+3H+ 2Fe3++Fe=3Fe2+ 2 1 6 6H+ 1 6 3 H2O ���¶��£�������ص��ܽ�ȱȸ������Ƶ��ܽ��С 11��3 Fe+8OH����6e��=FeO42��+4H2O
Fe��OH��3��������+3H+ 2Fe3++Fe=3Fe2+ 2 1 6 6H+ 1 6 3 H2O ���¶��£�������ص��ܽ�ȱȸ������Ƶ��ܽ��С 11��3 Fe+8OH����6e��=FeO42��+4H2O
����������1��FeCl3��ˮ��ԭ����FeCl3ˮ������Fe(OH)3���壬����ˮ�����������ʣ������ӷ���ʽ��ʾ��Fe3++3H2O![]() Fe��OH��3�����壩+3H+ ��Fe3����������ǿ������Fe����2Fe3++Fe=3Fe2+ ����2����������FeCl2��Һ��c��Fe2+��=2.0��10��2molL��1��c��Fe3+��=1.0��10��3molL��1��c��Cl����=5.3��10��2molL��1�����ݵ���غ㣬c(H��)+2c��Fe2+��+3c��Fe3+��=c��Cl����+c��OH������c(H��)=5.3��10��2molL��1-��2��2.0��10��2molL��1+3��1.0��10��3molL��1��=1.0��10��2molL��1��PH=-lg1.0��10��2=2�������Һ��PHԼΪ2����ClO3����ClԪ�ػ��ϼ���+5�۽���ΪCl-��-1�ۣ�Fe2+����Ԫ����+2������Ϊ+3�ۣ�Fe2+�ǻ�ԭ�������ϼ���������С������Ϊ6������Fe2+ϵ��Ϊ6��ClO3��ϵ��Ϊ1������ԭ���غ��֪��Fe3+ϵ��Ϊ6��Cl��ϵ��Ϊ1��H2Oϵ��Ϊ3��Ȼ��ͨ������غ㣬�������ӣ���ƽ�����ӷ���ʽΪ��1ClO3�� +6Fe2+ +6 H+= 1Cl�� + 6Fe3++ 3 H2O����3������ŨKOH��Һ������������أ�K2FeO4����˵�����¶��£�������ص��ܽ�ȱȸ������Ƶ��ܽ��С��Cl2����ClO����ClO3���DZ������Ĺ��̣����ϼ۷ֱ���0������Ϊ+1�ۺ�+5�ۣ����ⶨClO����ClO3�����ʵ���֮��Ϊ1��2�������ClO��Ϊ1mol��ClO3��Ϊ2mol������������Ԫ�ص����ʵ���Ϊ��1mol+2mol=3mol�����ݻ��ϼ۱仯��֪����Ӧ��ʧȥ���ӵ������ʵ���Ϊ��1mol����1-0��+2mol����5-0��=11mol��������ԭ��Ӧ�е�ʧ������Ŀһ����ȣ���÷�Ӧ��ʧȥ���ӵ����ʵ���Ҳ��11mol��Cl2����KCl�DZ���ԭ�Ĺ��̣����ϼ���0�۽���Ϊ-1�ۣ���ԭ��Cl�����ʵ���Ϊ��
Fe��OH��3�����壩+3H+ ��Fe3����������ǿ������Fe����2Fe3++Fe=3Fe2+ ����2����������FeCl2��Һ��c��Fe2+��=2.0��10��2molL��1��c��Fe3+��=1.0��10��3molL��1��c��Cl����=5.3��10��2molL��1�����ݵ���غ㣬c(H��)+2c��Fe2+��+3c��Fe3+��=c��Cl����+c��OH������c(H��)=5.3��10��2molL��1-��2��2.0��10��2molL��1+3��1.0��10��3molL��1��=1.0��10��2molL��1��PH=-lg1.0��10��2=2�������Һ��PHԼΪ2����ClO3����ClԪ�ػ��ϼ���+5�۽���ΪCl-��-1�ۣ�Fe2+����Ԫ����+2������Ϊ+3�ۣ�Fe2+�ǻ�ԭ�������ϼ���������С������Ϊ6������Fe2+ϵ��Ϊ6��ClO3��ϵ��Ϊ1������ԭ���غ��֪��Fe3+ϵ��Ϊ6��Cl��ϵ��Ϊ1��H2Oϵ��Ϊ3��Ȼ��ͨ������غ㣬�������ӣ���ƽ�����ӷ���ʽΪ��1ClO3�� +6Fe2+ +6 H+= 1Cl�� + 6Fe3++ 3 H2O����3������ŨKOH��Һ������������أ�K2FeO4����˵�����¶��£�������ص��ܽ�ȱȸ������Ƶ��ܽ��С��Cl2����ClO����ClO3���DZ������Ĺ��̣����ϼ۷ֱ���0������Ϊ+1�ۺ�+5�ۣ����ⶨClO����ClO3�����ʵ���֮��Ϊ1��2�������ClO��Ϊ1mol��ClO3��Ϊ2mol������������Ԫ�ص����ʵ���Ϊ��1mol+2mol=3mol�����ݻ��ϼ۱仯��֪����Ӧ��ʧȥ���ӵ������ʵ���Ϊ��1mol����1-0��+2mol����5-0��=11mol��������ԭ��Ӧ�е�ʧ������Ŀһ����ȣ���÷�Ӧ��ʧȥ���ӵ����ʵ���Ҳ��11mol��Cl2����KCl�DZ���ԭ�Ĺ��̣����ϼ���0�۽���Ϊ-1�ۣ���ԭ��Cl�����ʵ���Ϊ��![]() =11mol�����Ա���ԭ����Ԫ�غͱ���������Ԫ�ص����ʵ���֮��Ϊ11mol��3mol=11��3����4�����������������������ŵ�����FeO42���������Ǽ��Ի������ʵ缫����ʽΪ��Fe+8OH��-6e��=FeO42��+4H2O��
=11mol�����Ա���ԭ����Ԫ�غͱ���������Ԫ�ص����ʵ���֮��Ϊ11mol��3mol=11��3����4�����������������������ŵ�����FeO42���������Ǽ��Ի������ʵ缫����ʽΪ��Fe+8OH��-6e��=FeO42��+4H2O��