��Ŀ����
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��Q��R��X��Y��Zԭ��������������QԪ�ص�ԭ���γɵ����Ӿ���һ�����ӣ�R��̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��X��̬ԭ��s�ܼ����ܵ�������p �ܼ����ܵ�������1��Yԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����Zԭ�ӵļ۵����Ų�Ϊ3d74S2���ش��������⣺
��l��R��X��Y��һ�������ɴ�С��˳����________����Ԫ�ط��ţ�������Yԭ�ӵļ۵��ӹ����ʾʽΪ______________________��
��2��Q��RԪ���γɵ�ij�ĺ˷����й���14�����ӣ��÷�����Rԭ�Ӳ�ȡ______ �ӻ����÷��ӵ����幹��Ϊ___________��
��3��X��Q�γɵļ������ˮ��Һ�д��ڶ������,�α�ʾ����������_____________��_____________��
��4��RY���Ժͺܶ���ɽ����γ�������Fe��RY��5��Ni��RY��4������Fe��RY��5�����³�Һ̬���۵�Ϊ��20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ��ж�Fe��RY��5������
��______________��������ͣ�����RY��Ϊ�ȵ������������__________����дһ�֣���
��5����Z2+����Һ�м�������İ�ˮ����ͨ��������Y2���ݣ�������[Z��NH3��6]3+���ӣ���÷�Ӧ�����ӷ���ʽΪ_____________________________��
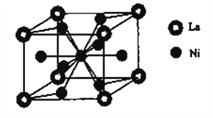
(6)����������(La)�γɵĺϽ���һ�����õĴ�����ϣ��侧���ṹʾ��ͼ����ͼ��ʾ���úϽ�Ļ�ѧʽΪ________________��
���𰸡� N>O>C ![]() sp ֱ���� N-H��N N-H��O ���Ӿ��� CN-��C22- 4Co2++24NH3��H2O+O2=4[Co(NH3)6]3++4OH-+22H2O LaNi5
sp ֱ���� N-H��N N-H��O ���Ӿ��� CN-��C22- 4Co2++24NH3��H2O+O2=4[Co(NH3)6]3++4OH-+22H2O LaNi5
�����������ڱ�ǰ�����ڵ�Ԫ��Q��R��X��Y��Zԭ��������������QԪ�ص�ԭ���γɵ����Ӿ���һ�����ӣ���QΪHԪ�أ�R��̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��ԭ�Ӻ���������Ų�ʽΪ1s22s22p2����RΪCԪ�أ�X��̬ԭ��s�ܼ����ܵ�������p�ܼ����ܵ�������1��ԭ�Ӻ���������Ų�ʽΪ1s22s22p3����XΪNԪ�أ�Yԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����ԭ�Ӻ���������Ų�ʽΪ1s22s22p4����YΪOԪ�أ�Zԭ�ӵļ۵����Ų�Ϊ3d74s2����ZΪCo��
(1)ͬ������ԭ����������Ԫ�ص�һ�����ܳ��������ƣ�NԪ��ԭ��2p���Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������ΪN��O��C��Yԭ�Ӻ���������Ų�ʽΪ1s22s22p4���۵��ӹ����ʾʽΪ![]() ���ʴ�Ϊ��N��O��C��
���ʴ�Ϊ��N��O��C��![]() ��
��
(2)H��CԪ���γɵ�ij�����й���14�����ӣ��÷���ΪC2H2��������Cԭ���ӻ������ĿΪ2��̼ԭ�Ӳ�ȡsp�ӻ����÷��ӵ����幹��Ϊֱ���Σ��ʴ�Ϊ��sp��ֱ���Σ�
(3)������ˮ��Һ�д��ڶ��������������N-H��N��N-H��O��O-H��O���ʴ�Ϊ��N-H��N��N-H��O��O-H��O(��д2��)��
(4)Fe(CO)5�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ������Ϸ��Ӿ�����е����ʣ��ݴ˿��ж�Fe (CO)5�������ڷ��Ӿ��壬CO��N2��Ϊ�ȵ����壬��CO��Ϊ�ȵ������������ CN-�ȣ��ʴ�Ϊ�����Ӿ��壻CN-�ȣ�
(5)��Co2+����Һ�м�������İ�ˮ����ͨ��������O2���壬������[Co(NH3)6]3+���ӣ����ݵ���غ��֪��OH-���ɣ���÷�Ӧ�����ӷ���ʽΪ��4Co2++24NH3��H2O+O2=4[Co(NH3)6]3++4OH-+22H2O���ʴ�Ϊ��4Co2++24NH3��H2O+O2=4[Co(NH3)6]3++4OH-+22H2O��
(6)ÿ�������У�Laλ�ڶ��㣬8��![]() =1��Niλ�����ĺ����ģ�1+8��
=1��Niλ�����ĺ����ģ�1+8��![]() =5����ѧʽΪLaNi5���ʴ�Ϊ��LaNi5��
=5����ѧʽΪLaNi5���ʴ�Ϊ��LaNi5��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�


