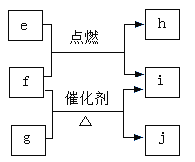
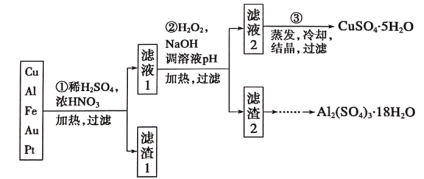
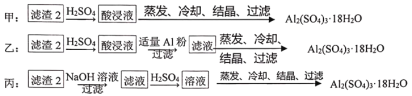
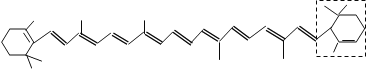
题目内容
【题目】锂盐二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰可用于制造离子电池的负极材料。合成方法如下:
2H2C2O4+SiCl4+2LiBF4=2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)26H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为_____。
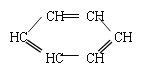
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是_______,1mol草酸分子中含有σ键的数目为______。
(3)与SiF4互为等电子体的阴离子的化学式为______。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为_______。
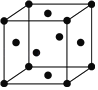
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数目为______。
【答案】1s22s22p63s23p63d4 sp2杂化 7NA SO42- CH3COOH可与H2O形成氢键 12
【解析】
(1)Mn是25号原子,Mn原子失去3个电子生成Mn3+,根据构造原理书写Mn3+基态核外电子排布式为1s22s22p63s23p63d4;
(2)草酸分子中C原子价层电子对个数是3,根据构造原理书写C原子轨道杂化类型为sp2;一个草酸分子中含有7个σ键,则1mol草酸中含有σ键的数目为7×6.02×1023;
(3)与SiF4互为等电子体的阴离子中含有5个原子且价电子数是32,所以与其互为等电子体的阴离子有SO42-、PO43-等;
(4)溶质分子和水分子之间形成氢键时能增大溶质的溶解度,乙酸与水分子间可形成氢键而导致乙酸易溶于水;
(5)Mn为面心立方最密堆积,每个Mn原子距离最近的Mn原子个数=3×8×![]() =12。
=12。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。