��Ŀ����
����Ŀ�����в���Ԫ�ص�������ԭ��![]() �����
�����![]() �ṹ�����ʾ��
�ṹ�����ʾ��
Ԫ�ر�� | Ԫ��������ԭ�� |
T | �����������Ǵ�����������3�� |
X | �����µ��ʷ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷ� |
Y | M���K����1������ |
Z | ��������Ԫ�صĽ��������а뾶��С |
��1������Ԫ��T��ԭ�ӽṹʾ��ͼ��__��
��2��Ԫ��Y��Ԫ��Z��ȣ������Խ�ǿ����__![]() ��Ԫ�ط��ű�ʾ
��Ԫ�ط��ű�ʾ![]() �����б�������֤����һ��ʵ����___
�����б�������֤����һ��ʵ����___![]() ����ĸ
����ĸ![]() ��
��
a.Y���ʵ��۵��Z���ʵ�
b.Y�Ļ��ϼ۱�Z��
c.Y������ˮ��Ӧ��Z������ˮ��Ӧ����
d.Y����������Ӧ��ˮ����ļ��Ա�Z��ǿ
��3��T��X��Y��Z�е�����Ԫ�����γɼ������Ӽ����зǼ��Թ��ۼ��Ļ����д���û�����Ļ�ѧʽ��__��
��4��T�����γ��ȶ���������Tm-��Y�����γ��ȶ���������Yn+����뾶��ϵΪr(Tm-)__r(Yn+)(����>������<������=��)
��5��X��Y��Z������������Ӧ��ˮ��������������Ӧ��д��Y��Z������������Ӧ��ˮ����֮�䷴Ӧ�����ӷ���ʽ___��
���𰸡�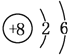 Na cd Na2O2 > Al(OH)3+OH-=AlO2-+2H2O
Na cd Na2O2 > Al(OH)3+OH-=AlO2-+2H2O
��������
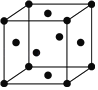
TԪ��ԭ�������������Ǵ�����������3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����TΪOԪ�أ�������X�ĵ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷԣ���XΪNԪ�أ�YԪ��ԭ��M���K����1�����ӣ���M�������Ϊ1����YΪNa����������Ԫ�صļ�������Z�İ뾶��С����ZΪAl��
��1��TΪOԪ�أ�ԭ�ӽṹʾ��ͼΪ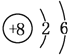 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2��Na��Alͬ���ڣ���ԭ�������������Լ�������Na�Ľ����Խ�ǿ��
![]() ���ʵ��۵������������ʣ����ܱȽϽ�����ǿ������a����
���ʵ��۵������������ʣ����ܱȽϽ�����ǿ������a����
![]() ������ǿ����ʧȥ���������йأ���ʧȥ������Ŀ�����أ����뻯�ϼ۸ߵ��أ���b����
������ǿ����ʧȥ���������йأ���ʧȥ������Ŀ�����أ����뻯�ϼ۸ߵ��أ���b����
![]() ������ˮ��Ӧ��Al���ʾ��ң�˵��Na�����Ը�ǿ����c��ȷ��
������ˮ��Ӧ��Al���ʾ��ң�˵��Na�����Ը�ǿ����c��ȷ��
![]() ����������ˮ����ļ��Ա�Alǿ��˵���ƵĽ����Ը�ǿ����d��ȷ��
����������ˮ����ļ��Ա�Alǿ��˵���ƵĽ����Ը�ǿ����d��ȷ��
�ʴ�Ϊ��Na��cd��
��3��O��N��Na��Al��������Ԫ�����γɼ������Ӽ����й��ۼ��Ļ�����û�����Ϊ![]() ��
��
�ʴ�Ϊ��![]() ��
��
��4��O�����γ��ȶ���������![]() ��Na�����γ��ȶ���������
��Na�����γ��ȶ���������![]() ����뾶��ϵΪ
����뾶��ϵΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��5��N��Na��Al������������Ӧ��ˮ��������������Ӧ��Na��Al������������Ӧ��ˮ����ֱ����������ƺ���������������֮�䷴Ӧ�����ӷ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�����Ŀ�������ǵ�(N2O)��һ��ǿ�������壬����ת���ɿ�����Ⱦ��о������ǵ��ֽ�Ի�����������Ҫ���塣
��1����ˮ�����ѵ������У�������������£�����刺ɷֽ�ΪN2O����һ�ֲ���÷�Ӧ�Ļ�ѧ����ʽΪ___��
��2����֪��Ӧ2N2O(g)=2N2(g)+O2(g)�ġ�H=-163kJ/mol��1molN2(g)��1molO2(g)�����л�ѧ������ʱ�ֱ���Ҫ����945kJ��498kJ����������1molN2O(g)�����л�ѧ������ʱ��Ҫ���յ�����Ϊ___kJ��
��3����һ���¶��µĺ��������У���Ӧ2N2O(g)=2N2(g)+O2(g)�IJ���ʵ���������£�
��Ӧʱ��/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c��N2O��/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
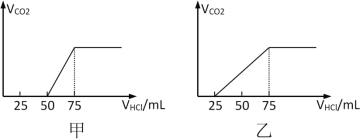
����0��20minʱ�Σ���Ӧ����v��N2O��Ϊ___molL-1min1��
����N2O��ʼŨ��c0Ϊ0.150 molL-1����Ӧ��30minʱN2O��ת������=___���Ƚϲ�ͬ��ʼŨ��ʱN2O�ķֽ����ʣ�v��c0=0.150molL-1��___v��c0=0.001molL-1�������������=����������
�۲�ͬ�¶ȣ�T���£�N2O�ֽ��˥������ʼѹǿ�ı仯��ϵ��ͼ��ʾ��ͼ�а�˥��ָ��һŨ��N2O����һ��ʱ�������Ӧʱ�䣩����T1____T2�����������=�������������¶�ΪT1����ʼѹǿΪp0����Ӧ��t1minʱ����ϵѹǿp=___����p0��ʾ����
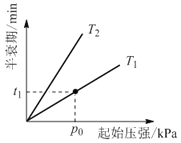
��4�������������ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ�� I2(g) ![]() 2I(g) ���췴Ӧ��
2I(g) ���췴Ӧ��
�ڶ��� I(g)+N2O(g)��N2(g)+IO(g) ������Ӧ��
������ IO(g)+N2O(g)��N2(g)+O2(g)+I(g) ���췴Ӧ��
ʵ�����������ʱN2O�ֽ����ʷ���v=kc��N2O��[c��I2��]0.5��kΪ���ʳ����������б�����ȷ����___�����ţ���
A.N2O�ֽⷴӦ�У�k(����)��k(��)
B.��һ�����ܷ�Ӧ�������������
C.�ڶ�����ܱȵ�������
D.I2Ũ����N2O�ֽ�������