题目内容
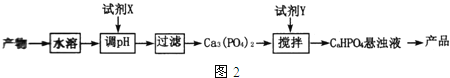
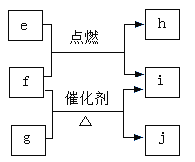
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,e、g、h、i、j均是由这些元素组成的二元化合物,i常温常压下为液体,其余均为无色气体。e的摩尔质量为g的2倍,f是元素Z的单质,g物质能使湿润的红色石蕊试纸变蓝,h的组成元素位于同一主族。上述物质的转化关系如图所示。下列说法正确的是
A.原子半径:Y>Z>W>XB.热稳定性:i>g, 沸点:i>e
C.Y与W的含氧酸均是强酸D.h与j均为酸性氧化物
【答案】B
【解析】
短周期元素W、X、Y、Z的原子序数依次增加。e、g、h、i、j是由这些元素组成的二元化合物,常温常压下i为液体,其余均为无色气体,因此i为水H2O;e的摩尔质量为g的2倍,f是元素Z的单质,g物质能使湿润的红色石蕊试纸变蓝,则g是NH3。根据转化关系图判断e是H2S,f是氧气,g是NH3,j是NO,h是SO2。所以X、Y、Z、W分别是H、N、O、S,根据此分析进行解答。
A.根据元素周期律的原子半径变化规律:同一周期的元素,原子序数越大原子半径越小,同一主族的元素,原子核外电子层数越多,原子半径越大,则原子半径的大小X<Z<Y<W,故A选项错误。
B.水和氨气分子间能够形成氢键,沸点较高,相对分子质量越大,沸点越高,热稳定性越高,故热稳定性:i>g,沸点:i>e,故B选项正确。
C.Y的含氧酸如亚硝酸为弱酸,W的含氧酸如亚硫酸也为弱酸,故C选项错误。
D.酸性氧化物指的是能与水作用成酸或与碱作用成盐的氧化物,判断依据是化学反应前后各元素化合价保持不变,显然NO不是酸性氧化物,故D选项错误。
故答案选B。

练习册系列答案
相关题目