题目内容
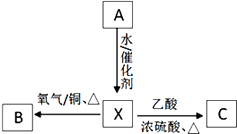
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
【答案】C
【解析】试题分析:A.Cl元素的化合价降低,得到电子被还原,则KClO3发生还原反应,A正确;B.C元素的化合价升高,失去电子被氧化,则H2C2O4在反应中被氧化,B正确;C.该反应中不能比较H2C2O4、ClO2的氧化性,C错误;D.由Cl元素的化合价变化可知,每1 mol ClO2生成,转移1mol×(5-4)=1mol电子,即该反应转移的电子数约为6.02×1023,D正确;答案选C。

练习册系列答案
相关题目