题目内容
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
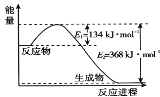
(1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _______________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1_________K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2)= v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。
N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。

①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填写“>”、“<”或“=”)。
(4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。

①B电极的反应式为_____________________________________。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为_________(标准状况)。
【答案】NO2(g)+CO(g)= NO(g)+CO2(g) ΔH=234 kJ mol1 > bc 2 > nA /2tA < CH4+4O2-8e =CO2+2H2O 1.12 L
【解析】
(1)由图可知:NO2和CO反应为放热反应,1 mol NO2和1 mol CO反应生成CO2 和NO放出234kJ的热量,据此写出热化学方程式;
(2)①由△H<0可知,该反应为放热反应,升高温度,平衡逆向移动,K减小;
②根据化学平衡状态的特征:正逆反应速率相等、各组分别浓度不变等来回答;
③400℃时,2NH3(g)![]() N2(g)+3H2(g)与 N2(g)+3H2(g)
N2(g)+3H2(g)与 N2(g)+3H2(g)![]() 2NH3(g)的平衡常数互为倒数关系;
2NH3(g)的平衡常数互为倒数关系;
计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行。
(3)①根据图像中数值用公式v=![]() 计算 v(CH3OH);
计算 v(CH3OH);
②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,则T1< T2;
(4)①由阴离子移动方向可以知道B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,A极是正极,该电极上是氧气得电子的还原反应;
②开始阶段发生反应:2Cu2++2H2O![]() 2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O
2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O![]() 2H2↑+ O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷。
2H2↑+ O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷。
(1)由图可知:NO2和CO反应的热化学方程式为:NO2(g)+CO(g)![]() CO2(g)+NO(g) △H=-234kJ/mol 。
CO2(g)+NO(g) △H=-234kJ/mol 。
因此,本题正确答案是:NO2(g)+CO(g)= NO(g)+CO2(g) ΔH=234 kJ mol1;
(2)①升高温度化学平衡向吸热反应方向移动。由于该反应的正反应是放热反应。所以升高温度化学平衡向逆反应方向移动。平衡越向逆反应方向移动,反应的平衡常数就越小。所以K1 >K2。
因此,本题正确答案是:>;
②a平衡时各物质的浓度与起始加入的物质的多少有关。只要平衡时各种物质的浓度不变,反应就达到了平衡。错误。
b.在任何时刻都有3 v正(N2)= v正(H2),而3v正(N2)= v逆(H2),代入第一个式子可得v正(H2)= v逆(H2)。反应达到平衡。正确。
c.由于容器的容积不变,若反应达到平衡,各种物质的物质的量不变,容器内压强也保持不变 。正确。
d.反应无论进行到什么程度,质量都不会发生变化,那么任何时刻混合气体的密度都保持不变。所以不能根据容器的容积不变来判断反应达到平衡。错误。
因此,本题正确答案是:bc;
③400℃时,2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数和反应N2(g)+3H2(g)
N2(g)+3H2(g)的化学平衡常数和反应N2(g)+3H2(g)![]() 2NH3(g)的化学平衡常数互为倒数。即为2。
2NH3(g)的化学平衡常数互为倒数。即为2。
由于浓度商Qc=![]() =
=![]() =
=![]() <0.5,所以反应向正反应方向移动。即v正(N2)>v逆(N2)。
<0.5,所以反应向正反应方向移动。即v正(N2)>v逆(N2)。
因此,本题正确答案是:2 ;> ;
(3)①根据图像,温度为T1时,从反应到平衡反应生成CH3OH的物质的量为nAmol,生成甲醇的平均速率v(CH3OH)=![]() = nA /2tA mol·L1·min1;
= nA /2tA mol·L1·min1;
因此,本题正确答案是:nA /2tA;
②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,根据温度对反应速率的影响知:T1< T2;
因此,本题正确答案是:<;
(4)①由阴离子移动方向可以知道B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极的反应式为CH4+4O2-8e =CO2+2H2O ,A极是正极,该电极上是氧气得电子的还原反应;
因此,本题正确答案是:CH4+4O2-8e =CO2+2H2O;
②硫酸铜的物质的量=0.1L×1mol/L=0.1mol,开始阶段发生反应:2Cu2++2H2O![]() 2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O
2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O![]() 2H2↑+ O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令氢气为xmol,
2H2↑+ O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令氢气为xmol,
根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1,
根据电子转移守恒,可以知道消耗甲烷的物质的量=![]() =0.05mol,
=0.05mol,
故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L,
因此,本题正确答案是:1.12L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案