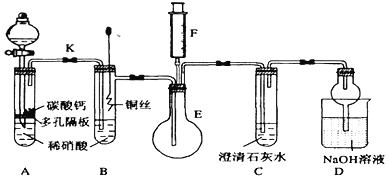
题目内容
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是

A. 曲线a表示Fe(OH)2饱和溶液中的变化关系
B. 除去CuSO4溶液中含有的少量Fe2+,可加入适CuO
C. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6 :1
D. 向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
【答案】C
【解析】A、该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则c(Fe2+)>c(Cu2+),离子浓度越大,-lgC(M2+)值越小,则相同条件下,饱和溶液中C(Fe2+)较大,所以Fe(OH)2饱和溶液中-lgC(Fe2+)较小,则b线表示Fe(OH)2饱和溶液中的变化关系,故A错误;B、Ksp[Cu(OH)2]<Ksp[Fe(OH)2],Cu(OH)2更易生成沉淀,在含有Fe2+的CuSO4溶液中,加入适量CuO,不能生成Fe(OH)2沉淀,所以Fe2+浓度不变,故B错误;C、当pH=10时,-lgC(Cu2+)=11.7,则Ksp[Cu(OH)2]=10-11.7×(10-4)2=10-19.7,C(Fe2+):C(Cu2+)=Ks[Fe(OH)2]:Ksp[Cu(OH)2]=10-15.1:10-19.7=1:10-4.6=104.6:1,故C正确;D、向X点对应的饱和溶液中加入少量NaOH,溶液中会生成Cu(OH)2沉淀,溶液中铜离子的浓度会减小,而从X点到Y点铜离子浓度不变,故D错误;故选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目