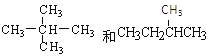题目内容
【题目】肼(N2H4)/空气燃料电池的能量转化率高,装置如图所示。电池放电时,电流由铜极经外电路流向铂极。下列说法错误的是( )

A.在铜极区填充空气
B.放电过程中,OH-向铂极迁移
C.负极反应式为N2H4—4e-=N2+4H+
D.放电过程中,铂极附近溶液pH降低
【答案】C
【解析】
电池放电时,电流由铜极经外电路流向铂极,则铜为正极,发生还原反应,铂为负极发生氧化反应。
A.肼(N2H4)/空气燃料电池中氧气被肼(N2H4)还原,所以空气应通入铜电极,故A正确;
B.放电过程为原电池,原电池中阴离子流向负极,即OH-向铂电极迁移,故B正确;
C.负极失电子发生氧化反应,即N2H4在负极失去电子被氧化成N2,但电解质溶液的酸碱性未知,若为碱性介质,负极反应为N2H4+4OH--4e-=N2+4H2O,若为酸性介质则电极反应为N2H4-4e-=N2+4H+,故C错误;
D.无论酸性介质还是碱性介质,铂电极均为负极,酸性介质时铂电极产生氢离子,pH降低,碱性介质中铂电极消耗氢氧根,pH降低,故D正确;
故答案为C。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
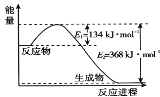
(1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _______________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1_________K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2)= v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。
N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。

①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填写“>”、“<”或“=”)。
(4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。

①B电极的反应式为_____________________________________。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为_________(标准状况)。
【题目】已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
【题目】天然气是一种清洁能源和重要化工原料。
(1)下列事实能说明CH4分子呈正四面体结构的是___(填字母)。
A.CH4分子的4个C—H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CH2F2没有同分异构体
D.CCl4的沸点高于CH4的
(2)甲烷与下列烃的通式相同的是___(填字母)。

(3)已知断裂几种化学键要吸收的能量如下:
化学键 | C—H | O=O | C=O | H—O |
断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
16gCH4在O2中完全燃烧生成气态CO2和气态水时___(填吸收”或放出”)约___ kJ热量。
(4)天然气/空气燃料电池中,若KOH为电解质,负极反应式为___。等质量的甲烷分别以稀硫酸、KOH溶液为电解质溶液完全放电时,理论上提供的电能之比为___。