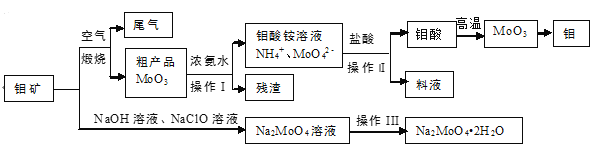
题目内容
【题目】巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
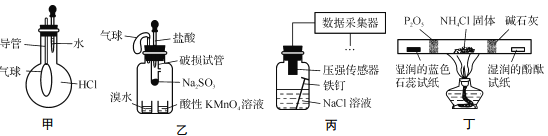
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
【答案】B
【解析】
A、烧瓶滴加水,HCl溶于水,造成烧瓶中压强减小,气球膨胀,能够达到实验目的,故说法正确;B、产生的SO2,使溴水、酸性高锰酸钾溶液褪色,发生的是氧化还原反应,不是漂白性,故说法错误;C、发生吸氧腐蚀,造成广口瓶中气体压强减小,发生析氢腐蚀,广口瓶中气体压强增大,能实现实验目的,故说法正确;D、NH4Cl受热分解成NH3和HCl,P2O5固体能吸收NH3,蓝色石蕊试纸变红,说明产生HCl,碱石灰吸收HCl,酚酞试纸变红,说明产生NH3,能实现实验目的,故说法正确。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
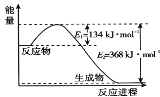
(1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _______________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1_________K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2)= v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。
N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。

①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填写“>”、“<”或“=”)。
(4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。

①B电极的反应式为_____________________________________。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为_________(标准状况)。
【题目】已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)