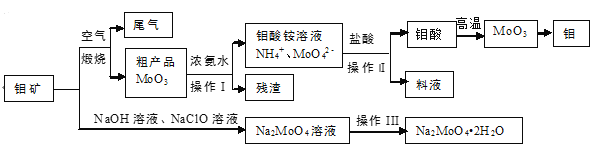
题目内容
【题目】亚氯酸钠常用作漂白剂。某化学小组设计实验制备亚氯酸钠,并进行杂质分析。
实验I 按图装置制备NaC1O2晶体

已知:①C1O2为黄绿色气体,极易与水反应。
②NaC1O2饱和溶液在低于38℃时析出NaC1O2·3H2O晶体,高于38℃时析出NaC1O2晶体,温度高于60℃时NaC1O2分解生成NaC1O3和NaCl。
(1)装置A中b仪器的名称是____;a中能否用稀硫酸代替浓硫酸____(填“能”或“不能”),原因是____。
(2)A中生成C1O2的化学反应方程式为____。
(3)C中生成NaC1O2时H2O2的作用是____;为获得更多的NaC1O2,需在C处添加装置进行改进,措施为____。
(4)反应后,经下列步骤可从C装置的溶液中获得NaC1O2晶体,请补充完善。
i.55℃时蒸发结晶 ii.__________ ii.用40℃热水洗涤 iv.低于60℃干燥,得到成品
实验Ⅱ 样品杂质分析
(5)上述实验中制得的NaC1O2晶体中还可能含有少量中学常见的含硫钠盐,其化学式为____,实验中可减少该杂质产生的操作(或方法)是____(写一条)。
【答案】蒸馏烧瓶 不能 ClO2极易与稀硫酸中的水反应,影响NaC1O2产率 2NaC1O3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O 作还原剂 将C装置放置于水浴中进行反应,控制温度在38℃~60℃ 趁热过滤(或38℃以上过滤) Na2SO4 控制浓硫酸滴速(或缓慢滴加浓硫酸或混合固体混合物时加入过量的NaC1O3等)
【解析】
装置A中制备得到ClO2,所以A中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,二氧化氯和氢氧化钠反应生成NaClO2,A中可能发生Na2SO3+ H2SO4(浓)= Na2SO4+SO2↑+H2O,产生的SO2被带入C中与NaOH反应生成Na2SO3,Na2SO3与H2O2反应生成Na2SO4,由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;装置B的作用是安全瓶,有防倒吸作用,从装置C的溶液获得NaClO2晶体,需要蒸发结晶、趁热过滤、洗涤、干燥,装置D是吸收多余气体防止污染。据此解答。
(1)根据仪器构造,装置A中b仪器的名称是蒸馏烧瓶;A中反应为氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯。由信息可知,C1O2极易与水反应,所以a中不能用稀硫酸代替浓硫酸,防止ClO2与稀硫酸中的水反应,影响NaC1O2产率。
故答案为:蒸馏烧瓶;不能;ClO2极易与稀硫酸中的水反应,影响NaC1O2产率;
(2)A中氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式应为2NaC1O3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,
故答案为:2NaC1O3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;
(3)C中二氧化氯和氢氧化钠反应生成NaClO2,氯元素化合价从+4价降到+3价,二氧化氯被还原,所以C中生成NaC1O2时H2O2的作用是作还原剂;
由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以为获得更多的NaC1O2,将C装置放置于水浴中进行反应,控制温度在38℃~60℃。
故答案为:作还原剂;将C装置放置于水浴中进行反应,控制温度在38℃~60℃;
(4)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,所缺步骤为趁热过滤(或38℃以上过滤)。
故答案为:趁热过滤(或38℃以上过滤);
(5)A中可能发生Na2SO3+ H2SO4(浓)= Na2SO4+SO2↑+H2O,产生的SO2被带入C中与NaOH反应生成Na2SO3,Na2SO3与H2O2反应生成Na2SO4,所以制得的NaC1O2晶体中混有Na2SO4;为减少Na2SO4产生,应尽量减少生成SO2,采取的操作可以是控制浓硫酸滴速(或缓慢滴加浓硫酸或混合固体混合物时加入过量的NaC1O3等)。
故答案为:Na2SO4;控制浓硫酸滴速(或缓慢滴加浓硫酸或混合固体混合物时加入过量的NaC1O3等)。

 名校课堂系列答案
名校课堂系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
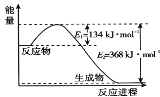
(1)下图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _______________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1_________K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2)= v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。
N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)。
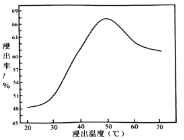
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。

①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填写“>”、“<”或“=”)。
(4)以甲烷为燃料的新型电池的成本大大低于以氢气为燃料的传统燃料电池,下图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。

①B电极的反应式为_____________________________________。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为_________(标准状况)。
【题目】已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
【题目】天然气是一种清洁能源和重要化工原料。
(1)下列事实能说明CH4分子呈正四面体结构的是___(填字母)。
A.CH4分子的4个C—H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CH2F2没有同分异构体
D.CCl4的沸点高于CH4的
(2)甲烷与下列烃的通式相同的是___(填字母)。

(3)已知断裂几种化学键要吸收的能量如下:
化学键 | C—H | O=O | C=O | H—O |
断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
16gCH4在O2中完全燃烧生成气态CO2和气态水时___(填吸收”或放出”)约___ kJ热量。
(4)天然气/空气燃料电池中,若KOH为电解质,负极反应式为___。等质量的甲烷分别以稀硫酸、KOH溶液为电解质溶液完全放电时,理论上提供的电能之比为___。