题目内容
7.已知下列物质在20℃下的Ksp如下:| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0X10-10 | 5.4X10-13 | 8.3X10-17 | 2.0X10-41 | 2.0X10-12 |
| A. | 20℃时.AgCl饱和溶液和Ag2CrO4饱和溶液中.Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl | |
| B. | 20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液.会先生成浅黄色沉淀 | |
| C. | 20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液,当两种沉淀共存时.c(Br-):C(C1-)=2.7×10-3 | |
| D. | 在100ml AgCl、AgBr、AgI饱和的混合溶液中加入足量浓AgNO3溶液,产生沉淀AgI质量最多 |
分析 A、依据溶度积常数计算银离子浓度比较判断;
B、根据溶度积常数计算各沉淀生成时所需银离子的浓度,从而判断生成沉淀的先后顺序;
C、根据溶度积常数计算$\frac{C(B{r}^{-})}{C(C{l}^{-})}$;
D、AgCl、AgBr、AgI三者中AgCl的溶解度最大,故在100ml AgCl、AgBr、AgI饱和的混合溶液中溶解的AgCl的质量最多.
解答 解:A、20℃时,在AgCl的饱和溶液中,Ag+物质的量浓度通过Ksp计算:Ksp=C(Ag+)×C(Cl-)=2.0×10-10,C(Ag+)=$\sqrt{2.0×1{0}^{-10}}$;Ag2CrO4饱和溶液中Ag+物质的量浓度通过Ksp计算:Ksp=C2(Ag+)C(CrO42-)=2.0×10-12,C(Ag+)=$\root{3}{2×1{0}^{-12}}$;故Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl,故A错误;
B、当生成AgCl沉淀时,所需银离子的浓度c(Ag+ )=$\sqrt{Ksp}$=$\sqrt{2.0×1{0}^{-10}}$=$\sqrt{2}$×10-5mol/l,当生成AgBr沉淀时,所需银离子的浓度c(Ag+ )=$\sqrt{Ksp}$=$\sqrt{5.4×1{0}^{-13}}$=$\sqrt{54}$×10-6mol/l,即生成AgBr沉淀时,所需银离子的浓度c(Ag+ )小,故首先析出的沉淀是AgBr,故B正确;
C、当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=$\frac{{K}_{sp}(AgBr)}{C(A{g}^{+})}$,c(Cl-)=$\frac{{K}_{sp}(AgCl)}{C(A{g}^{+})}$,则$\frac{C(B{r}^{-})}{C(C{l}^{-})}$=$\frac{5.4×1{0}^{-13}}{2.0×1{0}^{-10}}$=2.7×10-3.
故C正确;
D、已知常温下在水中溶解能力AgCl>AgBr>AgI,所以饱和溶液中的浓度AgCl>AgBr>AgI,所以再加入足量的浓AgNO3溶液,生成的AgCl沉淀最多,故D错误.
故选D.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度不大,本题注意溶度积常数的利用和理解.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
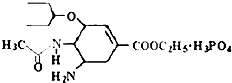 研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4•H3PO4,分子结构如图.下列有关奥司他韦的说法中正确的是( )
研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4•H3PO4,分子结构如图.下列有关奥司他韦的说法中正确的是( )| A. | 含极性键,易溶于水,其水溶液有丁达尔效应 | |
| B. | 分子中含有酯基、氨基、苯环等官能团 | |
| C. | 1mol 该物质最多能与3molNaOH反应 | |
| D. | 可以发生加成、取代、氧化反应、还原反应 |
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |||||||||||
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |||||||||||
| C. | 已知:
 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
| A. |  | B. |  | C. |  | D. |  |

 .
.
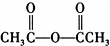 )
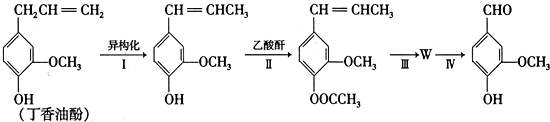
) 合成丁香油酚的反应类型为取代反应.
合成丁香油酚的反应类型为取代反应.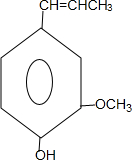 +CH3OCOCOCH3→
+CH3OCOCOCH3→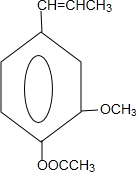 +CH3COOH
+CH3COOH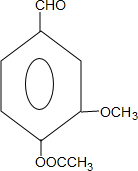 .
.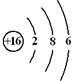 用电子式表示化合物 C2D 的形成过程
用电子式表示化合物 C2D 的形成过程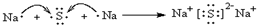
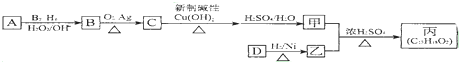
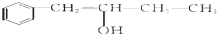
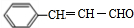
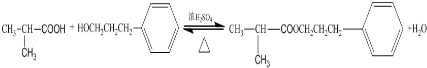 ,该反应类型为酯化反应:
,该反应类型为酯化反应: