题目内容
16.下列说法正确的是( )| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |||||||||||
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |||||||||||
| C. | 已知:
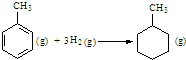 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
分析 A、从不同状态的物质之间的转化判断,一般来说,气体转化为液体、液体转化为固体放热,反之吸热;
B、在含有MgCO3固体的溶液中,Mg2+离子和CO32-离子不一定均来自于MgCO3,但溶度积常数只受温度的影响;
C、苯环中不存在典型的碳碳双键和碳碳单键,不能用表中数据进行计算;
D、NH3•H2O溶液中加入少量NH4Cl晶体,平衡向逆方向移动,电离程度降低.
解答 解:A、气体转化为液体是放热过程,焓变为负值,则正确的表达为:H2O(g)?H2O(l)△H=-40.69kJ•mol-1,故A错误;
B、含有固体MgCO3的溶液中,Mg2+离子和CO32-离子不一定均来自于MgCO3,故Mg2+离子和CO32-离子的浓度不一定相等,但在相同的温度下,溶度积常数不变,故B错误;
C、因为苯环中的碳碳键是介于单双键之间的一种独特的键,不存在典型的碳碳双键和碳碳单键,不能用以上表中进行计算,故C错误;
D、NH3•H2O溶液中存在电离平衡,加入少量NH4Cl晶体,NH4+浓度增大使电离平衡向逆方向移动,电离程度降低,溶液的pH减小,故D正确.
故选D.
点评 本题考查反应热、沉淀的溶解平衡、电离平衡等问题,本题易错点为C项,注意苯的结构特点,题目难度中等.

练习册系列答案
相关题目
6.某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出).晶体中的A、B、C的原子个数比依次为( )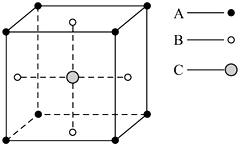

| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
7.已知下列物质在20℃下的Ksp如下:
下列说法不正确的是( )
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0X10-10 | 5.4X10-13 | 8.3X10-17 | 2.0X10-41 | 2.0X10-12 |
| A. | 20℃时.AgCl饱和溶液和Ag2CrO4饱和溶液中.Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl | |
| B. | 20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液.会先生成浅黄色沉淀 | |
| C. | 20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液,当两种沉淀共存时.c(Br-):C(C1-)=2.7×10-3 | |
| D. | 在100ml AgCl、AgBr、AgI饱和的混合溶液中加入足量浓AgNO3溶液,产生沉淀AgI质量最多 |
4.如图是氩元素在元素周期表中的具体信息.其中39.95是( )


| A. | 氩的原子序数 | B. | 氩原子的质量数 | ||
| C. | 氩元素的相对原子质量 | D. | 氩原子的相对原子质量 |
11.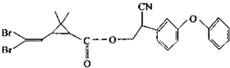 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 属于有机化合物 | ||
| C. | 不能发生取代反应 | D. | 在一定条件下可以发生加成反应 |
1.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 左、下方区域的金属元素 | |
| B. | 右、上方区域的非金属元素 | |
| C. | 金属元素与非金属元素分界线附近的元素 | |
| D. | 过渡元素中 |
6.含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫弱 | B. | 氢化物比HBr稳定 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
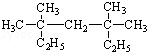 系统命名为3,3,5,5-四甲基庚烷
系统命名为3,3,5,5-四甲基庚烷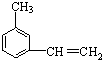
 .
.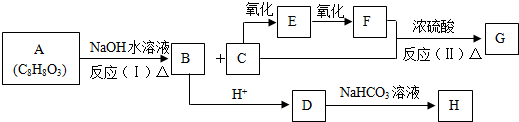
 ;B:
;B: ;E:HCHO G:HCOOCH3
;E:HCHO G:HCOOCH3 .
.