题目内容
15.第三周期元素中,基态原子轨道表示式中存在着空轨道的元素有( )种.| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 根据第三周期元素的基态原子的价电子排布式中只有3S23p1、3S23p2的p轨道存在空轨道分析.
解答 解:第三周期元素的基态原子的价电子排布式中只有3S23p1、3S23p2的p轨道存在空轨道,所以第三周期元素中,基态原子轨道表示式中存在着空轨道的元素有2种,故选:B.
点评 主要考查了第三周期元素中,基态原子轨道表示式中是否有空轨道的判断,难度不大,只要知道第三周期元素的基态原子的价电子排布式中只有3S23p1、3S23p2的p轨道存在空轨道即可解题.

练习册系列答案
相关题目
5.下列有关化学用语使用正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | NH4Cl的电子式: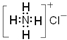 | |
| C. | 原子核内有10个中子的氧原子${\;}_{8}^{18}O$ | |
| D. | 次氯酸分子结构式 H-Cl-O |
6.某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出).晶体中的A、B、C的原子个数比依次为( )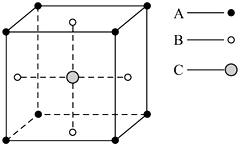

| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
3.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
| A. | ①⑤ | B. | ①③⑤⑧ | C. | ②④⑥⑦ | D. | ②④⑥ |
10.电子层数相同的X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
| A. | 原子半径X>Y>Z | B. | 稳定性HX>H2Y>ZH3 | ||
| C. | 非金属性X>Y>Z | D. | 阴离子的还原性Z3->Y2->X- |
20.用NA一表示阿伏加德罗常数的值.下列判断错误的是( )
| A. | NA个H+的质量为1g | |
| B. | 32g O2中含有2NA个O原子 | |
| C. | 2 L 0.5mol/LNa2SO4溶液中含NA个Na+ | |
| D. | 标准状况下,1 molH2O中含有10NA个质子 |
7.已知下列物质在20℃下的Ksp如下:
下列说法不正确的是( )
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0X10-10 | 5.4X10-13 | 8.3X10-17 | 2.0X10-41 | 2.0X10-12 |
| A. | 20℃时.AgCl饱和溶液和Ag2CrO4饱和溶液中.Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl | |
| B. | 20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液.会先生成浅黄色沉淀 | |
| C. | 20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液,当两种沉淀共存时.c(Br-):C(C1-)=2.7×10-3 | |
| D. | 在100ml AgCl、AgBr、AgI饱和的混合溶液中加入足量浓AgNO3溶液,产生沉淀AgI质量最多 |
4.如图是氩元素在元素周期表中的具体信息.其中39.95是( )


| A. | 氩的原子序数 | B. | 氩原子的质量数 | ||
| C. | 氩元素的相对原子质量 | D. | 氩原子的相对原子质量 |
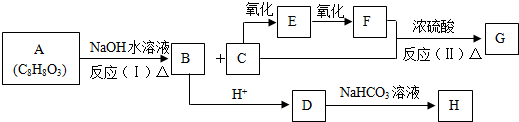
 ;B:
;B: ;E:HCHO G:HCOOCH3
;E:HCHO G:HCOOCH3 .
.