题目内容
20.物质的量浓度相同的三种正盐NaX、NaY、NaZ的水溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )| A. | HX>HZ>HY | B. | HZ>HY>HZ | C. | HX>HY>HZ | D. | HY>HZ>HX |
分析 根据酸根离子水解程度越大,其盐溶液碱性越强,对应的酸越弱来解答.
解答 解:因pH越大,其盐溶液碱性越强,说明酸根离子水解越是强烈,对应的酸越弱,所以HX、HY、HZ的酸性由强到弱的顺序:HX>HY>HZ,
故选C.
点评 本题考查盐类的水解,题目难度不大,注意酸根离子水解程度越大,对应的酸越弱.

练习册系列答案
相关题目
11.价电子排布为5s25p1的元素,在周期表中的位置是( )
| A. | 第4周期第VA族 | B. | 第5周期第IIIA族 | C. | 第5周期第Ⅳ族 | D. | 第4周期第IIIA族 |
8.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
.
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)④元素与⑦元素形成化合物的化学式MgCl2.
(4)①、②、⑥、⑦四种元素的最高价氧化物对应水化物中酸性最弱的是H2CO3 (填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)④元素与⑦元素形成化合物的化学式MgCl2.
(4)①、②、⑥、⑦四种元素的最高价氧化物对应水化物中酸性最弱的是H2CO3 (填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
5.某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示.

有关信息如下:
①反应原理:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如下表:
请回答下列问题:
(1)仪器A的名称是球形干燥管,其中装的试剂不可能是(填序号)B.
A.碱石灰 B.无水硫酸铜 C.氧化钙 D.烧碱
(2)整个实验过程中通N2的目的是排除装置中的空气,保证反应在无水无氧环境下进行.
(3)装置E中的试剂是浓硫酸;兴趣小组的甲同学认为实验中E装置不能换成A装置,理由是A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进.
(4)实验开始前的操作包括:组装仪器、检查装置的气密性、加装药品、通N2一段时间后点燃酒精灯.
(5)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(6)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有CO产生,反应的化学方程式为TiO2+2Cl2+2C $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;反应所需氯气可通过电解饱和食盐水制得,现电解1L饱和食盐水,当转移的电子数为0.1NA时,该溶液的pH值为13.

有关信息如下:
①反应原理:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管,其中装的试剂不可能是(填序号)B.
A.碱石灰 B.无水硫酸铜 C.氧化钙 D.烧碱
(2)整个实验过程中通N2的目的是排除装置中的空气,保证反应在无水无氧环境下进行.
(3)装置E中的试剂是浓硫酸;兴趣小组的甲同学认为实验中E装置不能换成A装置,理由是A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进.
(4)实验开始前的操作包括:组装仪器、检查装置的气密性、加装药品、通N2一段时间后点燃酒精灯.
(5)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(6)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有CO产生,反应的化学方程式为TiO2+2Cl2+2C $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;反应所需氯气可通过电解饱和食盐水制得,现电解1L饱和食盐水,当转移的电子数为0.1NA时,该溶液的pH值为13.
12.下表列出了A-R 9种元素在周期表中的位置:
(1)这9种元素分别为(写元素符号)ANa、BK、CMg、DAl、EC、FO、GCl、HBr、RAr,其中化学性质最不活泼的是Ar;
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程 .
.
(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程
 .
.(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
9.某学习小组用如下装置(支撑仪器略去)探究乙醇的催化氧化反应和乙醛的性质.

(1)实验开始时,对A进行水浴加热,其目的是产生平稳的乙醇气流.
(2)B中反应方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
(3)若装置C中开始发生倒吸,则采取的应急措施是c(填编号).
a.移去图中的酒精灯b.将C中橡皮塞上的短导气管拔出
c.将B尾端的乳胶管取下d.将A与B之间的乳胶管取下,
(4)探究:充分反应后,观察到溴水完全褪色.学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因.
①假设.请写出假设1的反应类型.
假设1:CH3CHO+Br2→CH2BrCHO+HBr;取代反应
假设2:CH3CHO+Br2→CH3CHBrOBr; 加成反应
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr. 氧化反应
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01mol,则证明假设3正确.
(5)欲检验乙醇中混有的少量乙醛,甲乙丙三同学设计实验如下表:
则上述方案中你认为能正确完成乙醛的检验的是乙(填甲、乙、丙)

(1)实验开始时,对A进行水浴加热,其目的是产生平稳的乙醇气流.
(2)B中反应方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
(3)若装置C中开始发生倒吸,则采取的应急措施是c(填编号).
a.移去图中的酒精灯b.将C中橡皮塞上的短导气管拔出
c.将B尾端的乳胶管取下d.将A与B之间的乳胶管取下,
(4)探究:充分反应后,观察到溴水完全褪色.学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因.
①假设.请写出假设1的反应类型.
假设1:CH3CHO+Br2→CH2BrCHO+HBr;取代反应
假设2:CH3CHO+Br2→CH3CHBrOBr; 加成反应
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr. 氧化反应
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01mol,则证明假设3正确.
(5)欲检验乙醇中混有的少量乙醛,甲乙丙三同学设计实验如下表:
| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
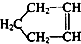 可简写为
可简写为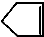 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: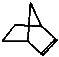
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. .
.