��Ŀ����
����Ŀ��������һ�������Դ��������ȡ��Ӧ��һֱ�������о����ȵ㡣
(1)�ü״���ˮ�����ڴ������������������������Ȼ�ѧ����ʽ���£�
CH3OH(g)=CO(g)+2H2(g)����H=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)����H=-41.2 kJ/mol
�ٷ�ӦCH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)���Է����е�ԭ����________��
CO2(g)+3H2(g)���Է����е�ԭ����________��
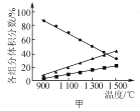
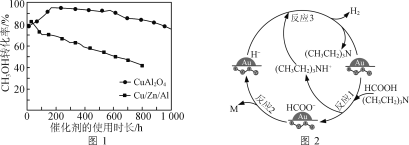
�ڽ�һ��������CH3OH(g)��H2O(g)�Ļ�����壬����ͬ����ͨ��װ�в�ͬ�����ķ�Ӧ����CH3OHת�����������ʹ��ʱ���仯��ͼ1��ʾ������CuAl2O4�����Cu/Zn/Al��ȣ��ŵ���____________________��
����Cu(NO3)2��Al(NO3)3�����Һ�еμ�NaOH��Һ�ɻ�ó�����[Cu(OH)2��Al(OH)3]���Ա�����ȡCuAl2O4��Ϊȷ��Cu2+��Al3+��ȫ������Ũ����10-5 mol/L����Ӧ���ƻ��ҺpH����С����ֵΪ________{Ksp[Cu(OH)2]=2.2��10-20��Ksp[Al(OH)3]=1.3��10-33}��
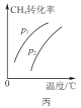
(2)��Au/ZrO2����������(CH3CH2)3N������HCOOH�ֽ������ԭ����ͼ2��ʾ����Ӧ2��������M�Ļ�ѧʽΪ__________________��ͼʾ��Ӧ��ֻ����Ԫ�ػ��ϼ۷����仯���Ƿ�Ӧ________������1����2������3������
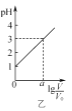
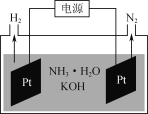
(3)��ͼ�ǵ�ⰱˮ��KOH�����Һ�����װ��ʾ��ͼ������N2�ĵ缫��ӦʽΪ______________��
(4)���������£�H2��ԭNOx���������Σ���һ��ΪH2��NOx�ڴ���������ת��ΪH2O��N2��NH3���ڶ���NH3�������������������NH4+��NH4+��NOx��ԭΪN2��д��NO��O2�����ʵ���֮��Ϊ1��1ʱ��NH4+��NO��O2��Ӧ����N2�����ӷ�Ӧ����ʽ��__________________________��
���𰸡�ͨ�������֪�÷�Ӧ��H=+49.5 kJ/mol����÷�Ӧ�ܹ��Է����е�ԭ������S>0 CuAl2O4�������Ը��ߣ���ʹ�ýϳ�ʱ����ܱ��ֽϸߵĻ��� 7 CO2 3 2NH3��H2O+6OH--6e-=N2��+8H2O 4NH4++2NO+2O2=3N2+6H2O+4H+
��������
(1)�ٸ�����֪�Ȼ�ѧ����ʽ����ϸ�˹���ɵõ��÷�Ӧ�ķ�Ӧ�ȣ�Ȼ�����÷�Ӧ�Է����е��ж����ݷ�����
�ڸ��ݴ����Ĵ����Ըߵͼ����ָ�Ч�Ե�ʱ�䳤�̷�����
�۸��ݳ������ܶȻ���������ֱ��γɳ���ʱ��Һ��pH����ȷ���γ����ֳ�������СpH��
(2)���ݷ�Ӧǰ��Ԫ���غ㼰�����еĵ����Ŀ��ȷ��M��ѧʽ������ͼʾ�з�Ӧǰ����������Ԫ�ػ��ϼ۷����ж�ֻ��HԪ�ػ��ϼ۷����仯�ķ�Ӧ��
(3)�ڸõ��װ���У�H+�������õ����ӣ�����H2��NH3��H2O��-3�۵�Nʧȥ���ӣ�����������Ӧ����N2��
(4)NH4+��NOx��ԭΪN2������NO��O2�����ʵ���֮��Ϊ1��1����ϵ����غ㡢ԭ���غ�͵���غ���д��Ӧ����ʽ��
(1)��(i)CH3OH(g)=CO(g)+2H2(g)����H=+90.7 kJ/mol
(ii)CO(g)+H2O(g)=CO2(g)+H2(g)����H=-41.2 kJ/mol
���ݸ�˹���ɣ���(i)+(ii)�������ɵ�CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ����H=+49.5 kJ/mol>0���÷�Ӧ������Ӧ�������������ķ�Ӧ�����ݷ�Ӧ�Է����е��ж�������G=��H-T��S<0������Ӧ�ܹ��Է����У�������H>0����÷�Ӧ�ܹ��Է����е�ԭ������S>0��
CO2(g)+3H2(g) ����H=+49.5 kJ/mol>0���÷�Ӧ������Ӧ�������������ķ�Ӧ�����ݷ�Ӧ�Է����е��ж�������G=��H-T��S<0������Ӧ�ܹ��Է����У�������H>0����÷�Ӧ�ܹ��Է����е�ԭ������S>0��
�ڸ���ͼʾ��֪������ͬ�¶��´���CuAl2O4�ȴ���Cu/Zn/Al�Ĵ����Ըߣ���ʹ�ýϳ�ʱ����ܱ��ֽϸߵĻ��ԣ���˴���CuAl2O4�ȴ���Cu/Zn/Al���ã�
������Ksp[Cu(OH)2]=2.2��10-20����Cu2+�γɳ�����Ҫc(OH-)=![]() =4.7��10-8 mol/L������Ksp[Al(OH)3]=1.3��10-33����Al3+�γɳ�����Ҫc(OH-)=
=4.7��10-8 mol/L������Ksp[Al(OH)3]=1.3��10-33����Al3+�γɳ�����Ҫc(OH-)=![]() =5.1��10-10 mol/L����ȻAl3+��ȫ�γɳ�����Ҫ��Һ��c(OH-)��С����Cu(NO3)2��Al(NO3)3�����Һ�еμ�NaOH��Һ�ɻ�ó�����[Cu(OH)2��Al(OH)3]���Ա�����ȡCuAl2O4��Ϊȷ��Cu2+��Al3����ȫ������Ӧ�ø���Cu2+�γɳ�����Ҫ��pH�����жϣ�c(H+)=
=5.1��10-10 mol/L����ȻAl3+��ȫ�γɳ�����Ҫ��Һ��c(OH-)��С����Cu(NO3)2��Al(NO3)3�����Һ�еμ�NaOH��Һ�ɻ�ó�����[Cu(OH)2��Al(OH)3]���Ա�����ȡCuAl2O4��Ϊȷ��Cu2+��Al3����ȫ������Ӧ�ø���Cu2+�γɳ�����Ҫ��pH�����жϣ�c(H+)=![]() mol/L=2.13��10-7 mol/L��pH��7����Ӧ���ƻ��ҺpH����С����ֵΪ7��
mol/L=2.13��10-7 mol/L��pH��7����Ӧ���ƻ��ҺpH����С����ֵΪ7��
(2)�ڷ�Ӧ2�У���Ӧ����HCOO-����������H-��M�����ݵ���غ㼰Ԫ���غ㣬��֪M�Ļ�ѧʽΪCO2���ڷ�Ӧ1��Ԫ�ػ��ϼ۷����仯��Ԫ����C��NԪ�أ��ڷ�Ӧ2��Ԫ�ػ��ϼ۷����仯��Ԫ����H��CԪ�أ��ڷ�Ӧ3��H+��H-����γ�H2��ֻ��HԪ�ػ��ϼ۷����仯�����ͼʾ��Ӧ��ֻ����Ԫ�ػ��ϼ۷����仯���Ƿ�Ӧ3��
(3)��ⰱˮ��KOH�����Һ������������Һ��ˮ���������H+�õ����ӣ�����ԭ����H2���缫��ӦʽΪ��2H++2e-=H2������������һˮ�ϰ��õ���������N2��������N2�ĵ缫��ӦʽΪ2NH3��H2O+6OH--6e-=N2��+8H2O��
(4)NH4+��NOx��ԭΪN2����NO��O2�����ʵ���֮��Ϊ1��1ʱ����ϵ����غ㡢����غ��ԭ���غ㣬�ɵø÷�Ӧ�ķ���ʽΪ��4NH4++2NO+2O2=3N2+6H2O+4H+��

����Ŀ����(Ti)����Ϊ��δ�����������㷺Ӧ���ڹ��������պ��졢������ϵ������ѵ��Ȼ���������ת���ϵ��2TiCl3![]() TiCl4��+TiCl2�ش��������⡣
TiCl4��+TiCl2�ش��������⡣
(1)ijͬѧ������̬ Cl-����Χ�����Ų�ͼΪ![]() ����Υ����____________
��������____________
(2)�ӽṹ�ǶȽ��� TiCl3��Ti(III)��ԭ�Խ�ǿ��ԭ��____________��
(3)�ѵ��Ȼ���IJ��������������±���
�Ȼ��� | �۵�/�� | �е�/�� | �ܽ��� |
TiCl4 | -24 | 136 | �����ڷǼ��Եļױ����ȴ��� |
TiCl2 | 1035 | 1500 | �������ȷ¡����� |
��TiCl4��TiCl2�ľ������ͷֱ���____________��
��TiCl4��SO42-��Ϊ�ȵ����壬��Ϊ����____________��ͬ��SO42-����ԭ����3s�����3p����ӻ���
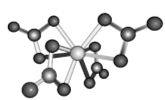
(4)Ti��������ж��֡�Ti(CO)6��Ti(H2O)63+��TiF62-����������ԭ���е縺����С����__________��Ti(NO3)4������ṹ��ͼ��Ti����λ����_____________
(5)���ѿ�(CaTiO3)����Ȼ���е�һ�ֳ�������侧���ṹ��ͼ��
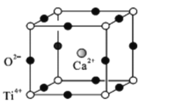
����NΪ�����ӵ�������ֵ������һ������������Ϊ______________g.
�ڼ���O2-���������������ܶѻ���Ti4+��O2-���У���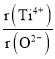 =_________��
=_________��
����Ŀ�����������������Ӧ�Լ�������Ӧ�����ӷ���ʽ��ȷ����(������
������ | �����Լ� | ���ӷ���ʽ | |
A | Na���� | Ba(OH��2��Һ | 2Na���� |
B | H����Cl�� | ����ʯ���� | 2H����2OH��=2H2O |
C | K���� | NaHSO4��Һ |
|
D | Ag���� | �������� | Ag���� |
A.AB.BC.CD.D