��Ŀ����
����Ŀ������������(CH3CH2CH2CH2OOCCH3)��һ���������л��ܼ���ʵ�����Ʊ����������������ķ�ӦΪCH3COOH+CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OOCCH3+H2O��
CH3CH2CH2CH2OOCCH3+H2O��
ʵ�鲽�����£�
����1��������A�м���11.5 mL������(����ˮ)��1 mLŨH2SO4��7.2 mL�����ἰ��ʯ������
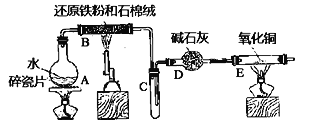
����2������ͼ����װ�á�
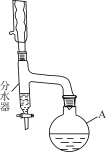
����3�����ˮ����Ԥ�ȼ�����ˮ(�Ե���֧�ܿ�)��ͨ����ȴˮ�����Ȼ�����
����4������ˮ���ֳ�������ͷ�ӦҺ�ϲ�ת���Һ©���У�������5% Na2CO3��Һ��ˮϴ�ӣ�������л��ࡣ
����5�����л�������ˮ����þ������ˡ������ռ�������������
(1)����A��������________�������м������Ƭ��Ŀ����________��
(2)װ���з�ˮ����������________���жϷ�Ӧ�Ѿ���ɵı�־��________��
(3)��Ӧʱ���ɵ���Ҫ�л��������ж��Ѻ�________(�ýṹ��ʽ��ʾ)��
(4)����4�У�������л���ľ��������___________________��
���𰸡�Բ����ƿ ��ֹ���� �����������Ӧ���ɵ�ˮͬʱ��������������������ƿ�м�����Ӧ ˮ��߶Ȳ��ٱ仯 CH3CH2CH=CH2 �ȷų��²��ˮ�㣬�ٽ��л�����Ͽڵ���һ��������ձ���
��������
(1)���������ṹ�ж��������ƣ�Һ���������ʱ�������Ƭ�ɷ�ֹ���У�
(2)��ϲ��������ʼ��������ķе�ͣ��ӷ������ˮ�����Ҳ�������ˮ������
(3)��ϴ��Ļ�ѧ�����뷴Ӧ�¶ȵĹ�ϵ�����жϣ�
(4)���������ܶȱ�ˮС��������ˮ������
(1)����ͼʾ��֪����A��Բ����ƿ�������м������Ƭ��Ŀ���Ƿ�ֹ������������
(2)��������������Ũ�������ʱ���ڼ��������·���������Ӧ����������������ˮ�������������е�Ƚϵͣ��ӷ�������ˮ���ܣ���Ӧ���ɵ�����ˮ�ͻӷ���δ��Ӧ�Ĵ������ˮ������ˮ�����ܷ����������Ӧ���ɵ�ˮ��ͬʱ��������ʹ��������������������ƿ�м�����Ӧ�������ԭ�������ʣ�
����Ӧ��ȫ���������������ӷ����з�ˮ���У���ˮ����Һ�治���ߣ���ʱ˵����Ӧ�ﵽ�յ㣻
(3)�ڼ���ʱ��Ӧʱ�������в�������������֮����ˮ�γɸ����ﶡ�ѣ��������¶ȹ��ߣ����ᷢ����������������ˮ����1-��ϩ��CH3CH2CH=CH2���ʸ÷�Ӧ���л��������ж��Ѻ�CH3CH2CH=CH2��
(4)��Ӧ������������������������ˮ���ܶȱ�ˮС��Һ�壬���뻥�����ܵ�����Һ������ʹ�÷�Һ�������룬���������ͨ����Һ©���¿��ȷų��²��ˮ�㣬Ȼ��رջ������ٽ��л�����Ͽڵ���һ��������ձ��С�

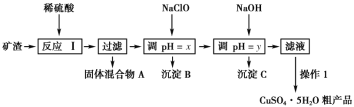
����Ŀ��ij�����ijɷ�ΪCu2O��Al2O3��Fe2O3��FeO��SiO2����ҵ���øÿ�����ȡͭ�͵����IJ���������ͼ��
��֪����Cu2O��2H+=Cu��Cu2+��H2O��
�ڲ���������������������ʽ����ʱ��Һ��pH���±���ʾ��
������ | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
��ʼ����pH | 5.4 | 4.0 | 2.7 | 5.8 |
������ȫpH | 6.7 | 5.2 | 3.7 | 8.8 |
��1��Ϊ�˼ӿ췴Ӧ�������ʣ����Բ�ȡ�Ĵ�ʩ��__(��д1��)��
��2����������A�еijɷ���__��
��3����Ӧ����ɺ���Ԫ�صĴ�����ʽΪ__(�����ӷ���)����������ӳ��õķ���֮һ�ǣ�ȡ�����������ӵ���Һ���Թ��У��μӼ������軯����Һ�������������д���÷�Ӧ�����ӷ���ʽ__��
��4������1��Ҫ������__��__��__��ϴ��CuSO4��5H2O�ֲ�Ʒ�����ô���ˮϴ�����ñ�ˮϴ�ӡ�ԭ����__��
��5����NaClO��pH�������ɳ���B����������������Ϣ��������BΪ__���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ__��
��6����NaOH��pH�������ɳ���C����������������Ϣ����y�ķ�ΧΪ__��