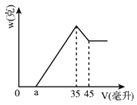
题目内容
【题目】按要求完成下列填空:
(1)氢氧化铝在碱性溶液中的电离方程式为_____。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加用硫酸酸化过的H2O2,溶液变红。写出相应反应的离子方程式_____,_____。
(3)右为某烃的球棍模型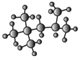 ,其名称(系统命名法)是_____
,其名称(系统命名法)是_____
以下写出相应的化学方程式
(4)铝粉与二氧化锰混合物在高温下反应_____
(5)氢氧化亚铁置于潮湿的空气中_____
(6)向已酸化的FeCl3溶液中加入铜粉_____
【答案】Al(OH)3AlO2﹣+H++H2O 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN﹣=Fe(SCN)3 2,2,4 —三甲基戊烷 4Al+3MnO2![]() 2Al2O3+3Mn 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2FeCl3+Cu=CuCl2+2FeCl2
2Al2O3+3Mn 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2FeCl3+Cu=CuCl2+2FeCl2
【解析】
(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠和水,说明氢氧化铝在碱性溶液中能部分电离出偏铝酸根离子和氢离子,则在碱性溶液中的电离方程式为:Al(OH)3AlO2﹣+H++H2O;
(2)在酸性条件下,亚铁离子被过氧化氢氧化为铁离子,发生的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,生成的Fe3+在溶液中遇SCN﹣,溶液变红色,发生的离子反应为Fe3++3SCN﹣=Fe(SCN)3;
(3)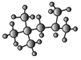 的结构简式为(CH3) 3CCH(CH3) 2,根据烷烃的系统命名此烷烃的名称为2,2,4—三甲基戊烷;
的结构简式为(CH3) 3CCH(CH3) 2,根据烷烃的系统命名此烷烃的名称为2,2,4—三甲基戊烷;
(4)铝粉和二氧化锰高温加热,发生铝热反应,生成氧化铝和Mn,反应方程式为4Al+3MnO2![]() 2Al2O3+3Mn;
2Al2O3+3Mn;
(5)氢氧化亚铁与氧气、水反应生成氢氧化铁,发生的化学反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(6)酸化的FeCl3溶液中加入铜粉,生成氯化亚铁和氯化铜,发生反应的化学方程式为2FeCl3+Cu=CuCl2+2FeCl2。