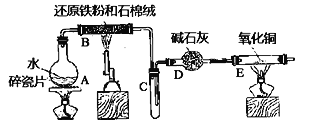
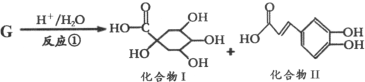
题目内容
【题目】根据下列图示所得出的结论正确的是( )
A.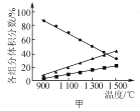 图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S
图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S
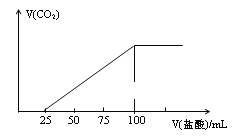
B.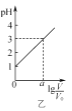 图乙表示V0 mL 0.1 mol·L-1的盐酸加水稀释至V mL,溶液的pH随lg
图乙表示V0 mL 0.1 mol·L-1的盐酸加水稀释至V mL,溶液的pH随lg![]() 的变化关系,则a=2
的变化关系,则a=2
C.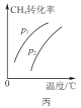 图丙表示密闭容器中CH4(g)+H2O(g)
图丙表示密闭容器中CH4(g)+H2O(g)![]() CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,说明p1>p2
CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,说明p1>p2
D.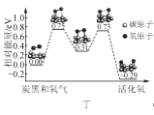 图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29 eV的能量
图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29 eV的能量
【答案】B
【解析】
A.一种物质的体积分数的变化量为50%-10%=40%,另一种生成物的体积分数的变化量为20%-10%=10%,不是1:1,不能说明反应生成H2和S,故A错误;
B.由溶液的pH随lg![]() 的变化关系,0.1 mol·L-1的盐酸加水稀释100倍,pH可由1变成3,即V0 mL 0.1 mol·L-1的盐酸加水稀释至V=100V0 mL,lg
的变化关系,0.1 mol·L-1的盐酸加水稀释100倍,pH可由1变成3,即V0 mL 0.1 mol·L-1的盐酸加水稀释至V=100V0 mL,lg![]() =2,则a=2,故B正确;
=2,则a=2,故B正确;
C.CH4(g)+H2O(g)![]() CO(g)+3H2(g)加压平衡逆向移动,甲烷的转化率降低,P2>P1,故C错误;
CO(g)+3H2(g)加压平衡逆向移动,甲烷的转化率降低,P2>P1,故C错误;
D.根据能量变化图分析,最终结果为活化氧,体系能量降低,则每活化一个氧分子放出0.29eV能量,故D错误;
故选B。

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目