题目内容
【题目】在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是 ( )
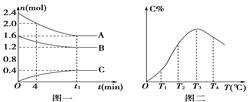
A. 该反应的平衡常数表达式为: 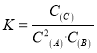
B. 0~4 min时,A的平均反应速率为0.01 mol/(L·min)
C. 由T1向T2变化时,v正>v逆
D. 平衡后升高温度,K值增大
【答案】D
【解析】A项,由图一可得,A和B为反应物、C为生成物,物质的量之比为:(2.41.6):(1.61.2):0.4=2:1:1,所以化学方程式为:2A+B![]() C,K=
C,K=![]() ,故A正确;B项,0~4 min时,A的平均反应速率为:v(A)=
,故A正确;B项,0~4 min时,A的平均反应速率为:v(A)= ![]() = 0.01 mol/(L·min),故B正确;C项,由图二可得,由T1向T2变化时,生成物C的百分含量正在增大,反应正在向右进行,所以v正>v逆,故C正确;D项由图二可得,T3℃时生成物C的百分含量达到最大值,T4℃时,C的百分含量降低,所以升高温度,K减小,平衡左移,故D错误。综上,选D。
= 0.01 mol/(L·min),故B正确;C项,由图二可得,由T1向T2变化时,生成物C的百分含量正在增大,反应正在向右进行,所以v正>v逆,故C正确;D项由图二可得,T3℃时生成物C的百分含量达到最大值,T4℃时,C的百分含量降低,所以升高温度,K减小,平衡左移,故D错误。综上,选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目