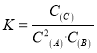题目内容
【题目】已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a = b
B.混合溶液的pH = 7
C.混合溶液中,c(H+) = ![]() mol/L
mol/L
D.混合溶液中,c(H+) +c(B) = c(OH) + c(A)
【答案】C
【解析】
试题分析:A.由于酸、碱的强弱不能确定,因此若a = b,混合后溶液不一定显中性,错误;B.由于温度不一定是室温,因此混合溶液的pH = 7时不一定显中性,错误;C.由于Kw=c(H+)·c(OH-),如混合溶液显中性,则,c(H+) = c(OH-)= ![]() mol/L,正确;D.在任何物质的溶液中都存在关系:c(H+) +c(B+) = c(OH) + c(A),与溶液是否先中性无关,错误。
mol/L,正确;D.在任何物质的溶液中都存在关系:c(H+) +c(B+) = c(OH) + c(A),与溶液是否先中性无关,错误。

【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=0.40/t1molL1min1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和0.10 mol H2O,达到平衡时n(CO2)=0.20 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO和H2O转化率增大
D. 温度升高至800℃,达到新平衡时n(CO2)=0.34 mol,则正反应为放热反应
【题目】某学习小组为探究MnO2与FeCl3·6H2O的反应,设计了下列装置:

查阅文献有如下信息:①FeCl3 熔点282℃,沸点315℃, 2FeCl3 ![]() 2FeCl2+Cl2↑
2FeCl2+Cl2↑
②FeCl6·6H2O 熔点37℃,沸点285℃
实验过程记录:
操作步骤 | 现象 |
1.检查装置气密性,添加相应药品, 点燃酒精灯,开始给试管A加热 | |
2.打开a,关闭b、c, 用湿润的蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
3.打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
4.打开c,关闭a、b | C中溶液变棕黄色 |
5.停止加热 |
回答下列问题:
(1)A中的白雾是________________________。
(2)管壁内形成黄色液滴,可能的原因是______________________。
(3)B中溶液变红,请用离子方程式解释其原因_______________________。
(4)对C中溶液变黄色,小组展开进一步实验:

Ⅰ.C中变黄的原因是___________________________________________。
Ⅱ.C中发生反应的离子方程式是________________________________。
(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,写出A中生成该固体的化学方程式____________________________________。
(6)在A中MnO2发生的化学反应为__________________________________。