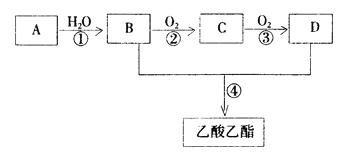
题目内容
【题目】某燃料电池的工作原理如图所示,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。

下列说法正确的是
A. 该电池放电时K+向石墨Ⅰ电极迁移
B. 石墨Ⅰ附近发生的反应:NO2-e- +NO![]() =N2O5
=N2O5
C. O2在石墨Ⅱ附近发生氧化反应,Y为NO
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为2∶1
【答案】B
【解析】A、原电池中阳离子定向移动到正极,K+向石墨Ⅱ电极迁移,选项B错误;
B、石墨I为原电池的负极,发生氧化反应,电极方程式为NO2-e- +NO![]() =N2O5,选项B正确;C、石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,Y为NO3-,选项C错误;D、电极方程式分别为4NO2+4NO3--4e-═4N2O5、O2+2N2O5+4e-═4NO3-,则放电过程中消耗的NO2和O2的体积比为4:1,选项D错误。答案选B。
=N2O5,选项B正确;C、石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,Y为NO3-,选项C错误;D、电极方程式分别为4NO2+4NO3--4e-═4N2O5、O2+2N2O5+4e-═4NO3-,则放电过程中消耗的NO2和O2的体积比为4:1,选项D错误。答案选B。

练习册系列答案
相关题目