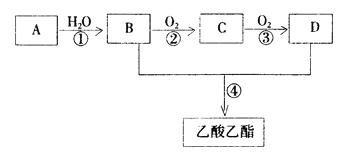
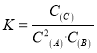题目内容
【题目】如图表示反应A(g)+B(g)nC(g)+Q (Q>0),在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是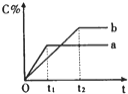
A. 反应由逆反应开始
B. 若n=2,其它条件相同,a比b的压强大
C. 若其它条件相同,a比b的温度高
D. a表示有催化剂,b表示无催化剂
【答案】C
【解析】A、C的百分含量从零开始逐渐增大,所以反应从正反应开始,故A错误;B、a到达平衡时间短,所以a压强高,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,所以n>2,故B错误;C、a到达平衡时间短,所以a温度高,升温平衡时C的百分含量(C%)减小,平衡逆向移动,所以△H<0(Q>0),故C正确;D、加入催化剂同等程度增大正逆反应速率,平衡不移动,则a、b到达平衡时C的百分含量相同,故D错误;故选C。

【题目】元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是
X | Y | Z | |
W | Q | M |
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为![]() 其二氢取代物有两种
其二氢取代物有两种
C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
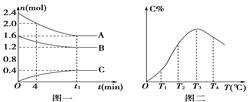
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=0.40/t1molL1min1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和0.10 mol H2O,达到平衡时n(CO2)=0.20 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO和H2O转化率增大
D. 温度升高至800℃,达到新平衡时n(CO2)=0.34 mol,则正反应为放热反应