题目内容
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是
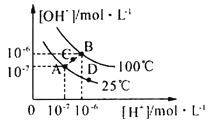
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
【答案】B
【解析】
A、Kw的影响因素为温度,水的电离吸热,升高温度Kw增大,A、D在同一等温线上,故图中A、B、D三点处Kw的大小关系为B>A=D,A错误;
B、25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,c(OH-)逐渐增大, c(OH-) c(NH4+) /c(NH3·H2O)的值不变,故c(NH4+) /c(NH3·H2O)逐渐减小,B正确;
C、在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系不能从A点变化到C点,体系从A点变化到C点,可采用加热的方法,C错误;
D、A点所对应的溶液呈中性,Fe3+因水解生成氢氧化铁沉淀不能大量存在,D错误。
故选B。

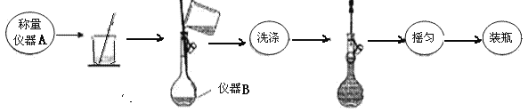
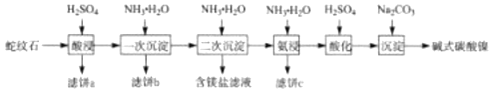
【题目】蛇纹石(含MgO、NiO、SiO2、Fe2O3、FeO等)因其外表青绿相问像蛇纹一样而得名。一种以蛇纹石为原料制取铁红和碱式碳酸镍[Ni3(OH)4CO34H2O]的流程如图:
已知:Ⅰ.该实验温度下,不同pH时铁沉淀物成分及热分解产物:
pH | 铁沉淀物成分 | 热分解产物 |
2.5 | NH4Fe3(SO4)2(OH)6 | Fe2O3,SO2,SO3,NH3,O2,H2O |
3.5 | α-FeOOH | Fe2O3,H2O |
Ⅱ.部分金属离子沉淀的pH:
Mg2+ | Fe2+ | Ni2+ | |
开始沉淀的pH | 9.4 | 6.5 | 6.7 |
沉淀完全的pH | 12.4 | 9.7 | 9.5 |
Ⅲ.“氨浸“后所得溶液中主要成分为[Ni(NH3)6]2+,且存在[Ni(NH3)6]2+ Ni2++6NH3请回答:
(1)滤饼a的主要成分为___。
(2)滤饼b经洗涤、煅烧可得铁红。则“一次沉淀”时应控制pH=__(填“2.5或“3.5”),其原因为___。
(3)“氨浸”时生成[Ni(NH3)6]2+的离子方程式为___;此过程会同时加入 NH4HCO3,其目的为___。
(4)“沉淀”前须先”酸化”,用平衡移动原理解释其原因为__。
(5)实验室测得Ni3(OH)4CO34H2O(M=377)样品在空气中受热时样品失重率(失重率=固体样品损失的总质量/起始加入样品的质量×100%)与温度(T)的关系如图所示。

①200oC时所得固体的化学式为___。
②250~350oC之间反应的化学方程式为___。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M![]() NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
【题目】向硝酸酸化的2mL0.1molL-1AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈粽黄色,试管底部仍存有黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行如下探究。
Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与____或___反应的产物。
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
液体试剂 | 加人铁氰化钾溶液 | |
1号试管 | 2mL.0.1molL-1AgNO3溶液 | 无蓝色沉淀 |
2号试管 | ______ | 蓝色沉淀 |
①2号试管中所用的试剂为____。
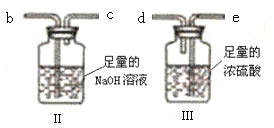
②资料显示:该温度下,0.1molL-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为____。
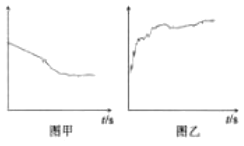
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1molL-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为___(填“图甲”或“图乙”)。
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为___。
Ⅱ.探究Fe3+产生的原因
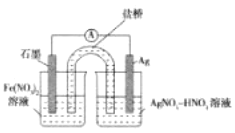
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
(3)方案一;取出少量黑色固体,洗涤后___(填操作和现象),证明黑色固体中有Ag。
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加人KSCN溶液,溶液变F红。该实验现象____(填“能“或“不能“)证明Fe2+可被Ag+氧化,理由为__。