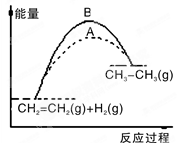
题目内容
下列说法正确的是:
A.在100 ℃、101 kPa条件下,1mol液态水气化时需要吸收40.69 kJ的热量,则H2O(g) H2O(l) 的ΔH = +40.69 kJ·mol-1 H2O(l) 的ΔH = +40.69 kJ·mol-1 |
| B.已知CH4 (g)+2O2(g)=CO2(g)+2H2O(l);△H=-802.33kJ/mol,则CH4的燃烧热为802.33 kJ |
C.H2(g)+Br2(g)=2HBr(g)△H=-72kJ·mol-1其它相关数据如下表: 则表中a为230 |
| D.已知S (g)+O2(g)=SO2(s);△H1,S (g)+O2(g)=SO2(g);△H2,则△H2<△H1 |
C
解析试题分析:A、该反应是放热反应,焓变小于0,错误;B、燃烧热的单位应为kJ·mol-1,错误;C、焓变等于反应物键能和减去生成物键能和,则有436+a-2×369=-72,a=230,正确;D、反应物一样,生成固体时放热更多,则焓变更小,错误。
考点:反应热的大小比较和焓变的计算。

练习册系列答案
相关题目
已知:2Zn(s)+O2(g)=2ZnO(s) △H="-701.0" kJ?mol-1
2Hg(I)+O2(g)=2HgO(s) △H="-181.6" kJ?mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(I)的△H为
| A.-519.4kJ?mol-1 | B.+259.7 kJ?mol-1 | C.-259.7 kJ?mol-1 | D.+519.4 kJ?mol-1 |
下列说法正确的是
A.已知: 则可以计算出反应 则可以计算出反应 的ΔH为-384 kJ/mol 的ΔH为-384 kJ/mol |
| B.辛烷的标准燃烧热为-5518 kJ/mol。则辛烷燃烧的热化学方程式可表示为: C8H18(g)+12.5O2(g)= 8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol |
C.2CO(g)+O2(g)=2CO2(g) ;ΔH=-566 kJ/mol 下图可表示该反应过程与能量的关系 |
| D.S(s)+O2(g)=SO2(g);ΔH1 S(g)+O2(g)=SO2(g);ΔH 2则ΔH1>ΔH2 |
下列说法或表示方法中正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(金刚石)→C(石墨)ΔH=" -1.9KJ/mol" 可知,金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH=" —53.7KJ/mol" ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |
已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0;则下列叙述不正确的是( )
| A.该反应的ΔH值与反应物用量无关 |
| B.该反应的化学能可以转化为电能 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量 |
100 g炭粉燃烧所得气体中,CO占 、CO2占
、CO2占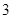 ,且C(s)+
,且C(s)+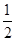 O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+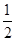 O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
| A.784.92 kJ | B.2 489.44 kJ | C.1 569.83 kJ | D.3 274.3 kJ |
(2013·广东中山一模,11)下列依据热化学方程式得出的结论正确的是(双选)( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |