题目内容
下列说法或表示方法中正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(金刚石)→C(石墨)ΔH=" -1.9KJ/mol" 可知,金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH=" —53.7KJ/mol" ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |
D
解析试题分析:A、硫蒸汽的能量比固体硫的能量高,因此放出的热量多,错误;B、金刚石的能量比石墨的能量高,因此金刚石不稳定,错误;C、ΔH=+571.6KJ/mol,错误; D、浓硫酸遇水要放热,正确。
考点:考查反应热的有关知识。

练习册系列答案
相关题目
化学与生活、生产息息相关,下列说法不正确的是
| A.煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 |
| B.测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义 |
| C.利用盐类的水解反应可以制备胶体对饮用水进行净化,也可以获得纳米材料 |
| D.通常条件下能够自发进行的反应必须具备△H和△S均小于零 |
下列说法正确的是:
A.在100 ℃、101 kPa条件下,1mol液态水气化时需要吸收40.69 kJ的热量,则H2O(g) H2O(l) 的ΔH = +40.69 kJ·mol-1 H2O(l) 的ΔH = +40.69 kJ·mol-1 |
| B.已知CH4 (g)+2O2(g)=CO2(g)+2H2O(l);△H=-802.33kJ/mol,则CH4的燃烧热为802.33 kJ |
C.H2(g)+Br2(g)=2HBr(g)△H=-72kJ·mol-1其它相关数据如下表: 则表中a为230 |
| D.已知S (g)+O2(g)=SO2(s);△H1,S (g)+O2(g)=SO2(g);△H2,则△H2<△H1 |
H2与O2发生反应的过程用模型图示如下(“—”表示化学键):下列说法不正确的是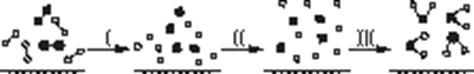
| A.过程Ⅰ是吸热过程 |
| B.过程Ⅲ一定是放热过程 |
| C.该反应过程所有旧化学键都断裂,且形成了新化学键 |
| D.该反应的能量转化形式只能以热能的形式进行 |
已知在25℃时:2C(s)+O2(g)=2CO(g) △H1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+82kJ/mol |
下列叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.需要加热才能发生的反应一定是吸热反应 |
| C.反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
下列反应中,生成物的总能量大于反应物的总能量的是
| A.氢气在空气中燃烧 | B.氢氧化钡晶体与氯化铵晶体反应 |
| C.盐酸与氨氧化钠溶液反应 | D.锌与稀硫酸反应制取氢气 |
下列说法中,正确的是
| A.放热反应不需要加热就可以发生 |
| B.化学反应除了生成新物质外,还伴随着能量的变化 |
| C.反应条件为加热的反应都是吸热反应 |
| D.化学反应放热还是吸热,取决于反应条件 |
