题目内容
反应A+B→C+Q(Q>0)分两步进行,① A+B→X+Q(Q<0) ② X→C+Q(Q>0)。下列示意图中,能正确表示总反应过程中能量变化的是
D
解析试题分析:由反应 A+B→C+Q(Q>0)分两步进行:①A+B→X+Q(Q<0),②X→C+Q(Q>0),由A+B→C+Q(Q>0)是放热反应,A和B的能量之和大于C的能量;由①A+B→X +Q(Q<0)可知这步反应是吸热反应,故X的能量大于A+B;由A+B→C+Q(Q>0)是放热反应,A和B的能量之和大于C和Q的能量之和,又 X→C+Q(Q>0)X的能量之和大于C的能量,故所以图象D符合。
考点:化学能与热能的相互转化

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列说法正确的是:
A.在100 ℃、101 kPa条件下,1mol液态水气化时需要吸收40.69 kJ的热量,则H2O(g) H2O(l) 的ΔH = +40.69 kJ·mol-1 H2O(l) 的ΔH = +40.69 kJ·mol-1 |
| B.已知CH4 (g)+2O2(g)=CO2(g)+2H2O(l);△H=-802.33kJ/mol,则CH4的燃烧热为802.33 kJ |
C.H2(g)+Br2(g)=2HBr(g)△H=-72kJ·mol-1其它相关数据如下表: 则表中a为230 |
| D.已知S (g)+O2(g)=SO2(s);△H1,S (g)+O2(g)=SO2(g);△H2,则△H2<△H1 |
下列反应中,生成物的总能量大于反应物的总能量的是
| A.氢气在空气中燃烧 | B.氢氧化钡晶体与氯化铵晶体反应 |
| C.盐酸与氨氧化钠溶液反应 | D.锌与稀硫酸反应制取氢气 |
下列说法中,正确的是
| A.放热反应不需要加热就可以发生 |
| B.化学反应除了生成新物质外,还伴随着能量的变化 |
| C.反应条件为加热的反应都是吸热反应 |
| D.化学反应放热还是吸热,取决于反应条件 |
如图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 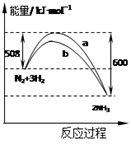
A.该反应的热化学方程式为:2NH3  N2+3H2ΔH =-92 kJ·mol-1 N2+3H2ΔH =-92 kJ·mol-1 |
| B.正反应的活化能小于逆反应的活化能 |
| C.a曲线是加入催化剂时的能量变化曲线 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
在压强为2.20×104 kPa、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
| A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应 |
| B.“水热反应”是一种复杂的物理化学变化 |
| C.火力发电厂可望利用废热,将二氧化碳转变为能源物质 |
| D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8 kJ热量,表示该反应的热化学方程式正确的是
| A.2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ/mol |
| C.2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol |
D.H2(g)+ O2(g)=H2O(l)△H=-285.8 kJ/mol O2(g)=H2O(l)△H=-285.8 kJ/mol |
下列关于热化学反应的描述中正确的是( )
| A.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热 ΔH=2×(-57.3) kJ·mol-1 |
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+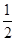 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1;则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1;则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2800 kJ·mol-1,则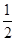 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1 |
