题目内容
【题目】中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
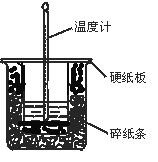
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)。
(3)做一次完整的中和热实验,温度计需要使用______次;
(4)该实验常用0.50 mol·L-1HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容c=4.18 J/(g·℃),反应后温度升高了△t,则生成1mol水时的反应热ΔH=___________ kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、不相等”),简述理由____________。
【答案】环形玻璃搅拌棒 保温、隔热 偏小 3 -0.418△t/0.025 不相等 因为醋酸电离需要吸收热量
【解析】
(1)在测定中和热的实验中为了使溶液混合均匀,在实验过程中需要搅拌,根据装置图可知还缺少环形玻璃搅拌棒。
(2)为了减少热量的损失需要在大小烧杯之间填满碎泡沫以起到保温和隔热的作用。如果没有盖硬质板,会造成热量的损失,导致测定结果偏小。
(3)盐酸和氢氧化钠溶液的温度都需要测量,反应后还需要测量混合液的温度,所以至少使用3次。
(4)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液的质量之和是100g,所以反应过程中放出的热量是100g×0.00418kJ/(g℃)×△t℃=0.418△tkJ。因为50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液反应生成水是0.025mol,所以△H=-0.418△t/0.025kJ/mol。
(5)因为醋酸是弱酸,在溶液中存在电离平衡,而电离是吸热的,所以放出的热量要少。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案