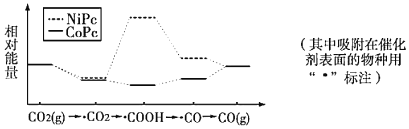
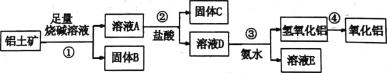
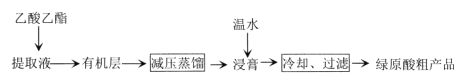
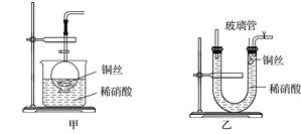
题目内容
【题目】—定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴 滴入某浓度稀盐酸,加入V(HC1)与生成n(CO2)的关系如图所示。下列有关叙述正确的是
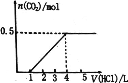
A.通入的CO2气体为11.2 L
B.A溶液中 n(NaHCO3) = 2n(Na2CO3)
C.A溶液中既含有NaOH,又含有Na2CO3
D.A溶液中可能含有NaOH和NaHCO3
【答案】C
【解析】
若溶质只有Na2CO3,加入盐酸开始发生Na2CO3+HCl=NaHCO3+NaCl,然后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,前后两阶段消耗盐酸体积之比为1∶1,而实际消耗盐酸体积为1∶(4-1)=1∶3,故溶质为Na2CO3、NaHCO3,据此分析解答。
由图可知,开始不生成气体,后来生成气体,且耗盐酸体积为1∶(4-1)=1∶3,故溶质为Na2CO3、NaHCO3,由NaHCO3+HCl=NaCl+CO2↑+H2O可知,n(CO2)=0.5mol,Vm未知,不能计算生成二氧化碳的体积,该反应消耗盐酸为0.5mol,n(NaHCO3)=0.5mol,由Na2CO3+HCl=NaHCO3+NaCl可知,n(HCl)=n(Na2CO3)=![]() ,则原NaHCO3为0.5mol-
,则原NaHCO3为0.5mol-![]() =
=![]() ,即A溶液中n(NaHCO3)=2n(Na2CO3),故选C。
,即A溶液中n(NaHCO3)=2n(Na2CO3),故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目