题目内容
9.2SO2(g)+O2(g)?2SO3(g),是工业制硫酸的重要反应,下列关于该反应的说法不正确的是( )| A. | 使用催化剂可增大该反应速率 | |
| B. | 增大O2的浓度能加快反应速率 | |
| C. | 该反应达到平衡时,正、逆反应速率相等但不为0 | |
| D. | 一定条件下,2 mol SO2和1 mol O2反应可以得到2 mol SO3 |
分析 A、加入催化剂可以改变化学反应速率,根据工业生产选择合适的催化剂;
B、增大物质的浓度能加快化学反应速率;
C、化学平衡是动态平衡;
D、该反应是可逆反应,不能进行彻底.
解答 解:A、加入催化剂可以加快化学反应速率,故A正确;
B、增大二氧化硫、氧气、三氧化硫的浓度均能加快该化学反应的速率,故B正确;
C、化学平衡是动态平衡,该反应达到平衡时,正、逆反应速率相等但不为0,故C正确;
D、可逆反应的反应物不能完全转化,一定条件下,2 mol SO2和1 mol O2反应得到SO3小于2 mol,故D错误;
故选D.
点评 本题考查影响化学反应速率的因素:温度、浓度、催化剂、压强等,注意催化剂的特点是解题的易错点,难度不大.

练习册系列答案
相关题目
14.等物质的量的氢气和氦气一定具有相同的( )
| A. | 原子数 | B. | 体积 | C. | 分子数 | D. | 质量 |

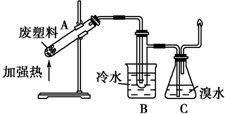 .塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题:
.塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题: .
. 某有机物结构如图,它不可能具有的性质是( )
某有机物结构如图,它不可能具有的性质是( )