题目内容
20.根据元素周期表1-18号元素的性质和递变规律,回答下列问题.(1)金属性最强的元素单质与氧气反应生成的化合物有Na2O、Na2O2(填两种化合物的化学式).
(2)最高价氧化物对应水化物酸性最强的是NaOH(填元素符号,下同),碱性最强的是HClO4;
(3)形成化合物种类最多的两种元素是C、H;
(4)推测Si、N最简单氢化物的稳定性NH3大于SiH4_(填化学式).
分析 (1)1-18号元素中金属Na的金属性最强,与氧气反应得到氧化钠、过氧化钠;
(2)金属性最强的元素在周期表的左下角位置,对应的最高价氧化物对应水化物的碱性最强;元素的非金属性越强,对应的最高价氧化物对应的水化物酸性越强;
(3)有机化合物的种类最多,据此判断形成化合物种类最多的元素;
(4)非金属性越强,气态氢化物越稳定.
解答 解:(1)金属性最强的为Na,与氧气反应生成的化合物有:Na2O、Na2O2,
故答案为:Na2O;Na2O2;
(2)金属性最强的元素在周期表的左下角位置,元素周期表1~18号元素中Na的金属性最强,其最高价氧化物对应水化物是NaOH,碱性最强;
Cl的非金属性仅次于O、F,但O、F无正价,最高价氧化物对应的水化物HClO4酸性最强,
故答案为:NaOH;HClO4;
(3)有机化合物的种类最多,主要含C、H元素,
故答案为:C、H;
(4)同周期元素的原子,从左到右得电子能力逐渐增强,氢化物越来越稳定,所以稳定性氨气>甲烷,同主族元素的原子,从上到下得电子能力逐渐减弱,氢化物越来越不稳定,所以稳定性硅烷<甲烷,所以NH3的稳定性强于SiH4,
故答案为:SiH4;NH3.
点评 本题考查元素周期表的结构及应用,题目难度中等,侧重元素在周期表的位置及元素周期律的考查,把握原子半径的比较规律及非金属性的比较方法为解答的关键.

练习册系列答案
相关题目
10. 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
CH3CH2CH2CH2OH $→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)加入沸石的作用是防止暴沸
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是:保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%
(8)已知正丁醛在碱性条件下可以被新制氢氧化铜氧化,写出该反应的化学方程式:CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O.
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH $→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/0C | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)加入沸石的作用是防止暴沸
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是:保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%
(8)已知正丁醛在碱性条件下可以被新制氢氧化铜氧化,写出该反应的化学方程式:CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O.
11.在某温度时,pH=3的某水溶液中c(OH-)=10-9 mol/L,现有该温度下的四份溶液:①pH=2的CH3COOH、②0.01mol/L的HCl、③pH=11的氨水、④pH=11的NaOH溶液,下来说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若pH=7,则消耗溶液的体积②=③ | |
| C. | 将四份溶液稀释相同的倍数后,溶液的pH:③>④>②>① | |
| D. | 将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液一定呈碱性 |
8.苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置(图A中的加热装置没有绘出)制取高纯度的苯甲酸甲酯,实验前他们从有关化学手册中查得有关物质的物理性质如表所示
实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式 ,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
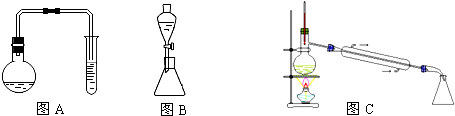
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置后,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6 0C 时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式
 ,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置后,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6 0C 时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.
15.下列各组物质中含氧原子的物质的量相同的是( )
| A. | 0.3mol O2和 0.3mol H2O | |
| B. | 0.1mol H2SO4和3.6g H2O | |
| C. | 0.1mol MgSO4•7H2O和0.1mol C12H22O11(蔗糖) | |
| D. | 6.02×1023个CO2与0.1mol KMnO4 |
9.2SO2(g)+O2(g)?2SO3(g),是工业制硫酸的重要反应,下列关于该反应的说法不正确的是( )
| A. | 使用催化剂可增大该反应速率 | |
| B. | 增大O2的浓度能加快反应速率 | |
| C. | 该反应达到平衡时,正、逆反应速率相等但不为0 | |
| D. | 一定条件下,2 mol SO2和1 mol O2反应可以得到2 mol SO3 |
10.已知在100℃时,水的离子积常数Kw=1×10-12,在100℃时,下列说法正确的是( )
| A. | 0.005mol/L的Ba(OH)2溶液,pH=10 | |
| B. | 0.001mol/L的CH3COOH溶液,pH=3 | |
| C. | 0.005mol/L的H2SO4溶液与0.01mol/L的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50ml,需要pH=9的NaOH溶液100ml |
 (1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.
(1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.