题目内容
1.0.5mol O3 (臭氧)中含有的分子数是0.5NA个、原子数是1.5NA个、质子数是12NA个.0.5mol的Fe含0.5NA个铁原子,质量是28g,1mol CO(NH2)2中含1mol碳原子.分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算.
解答 解:0.5mol O3 (臭氧)中含有的分子数是0.5NA个、原子数是1.5NA个,每个O原子含有8个质子,则质子数是12NA个,0.5mol的Fe含0.5NA个铁原子,质量是0.5mol×56g/mol=28g,1mol CO(NH2)2中含1mol碳原子.
故答案为:0.5NA;1.5NA;12NA;0.5NA;28;1.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意有关公式的利用.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
11.在某温度时,pH=3的某水溶液中c(OH-)=10-9 mol/L,现有该温度下的四份溶液:①pH=2的CH3COOH、②0.01mol/L的HCl、③pH=11的氨水、④pH=11的NaOH溶液,下来说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若pH=7,则消耗溶液的体积②=③ | |
| C. | 将四份溶液稀释相同的倍数后,溶液的pH:③>④>②>① | |
| D. | 将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液一定呈碱性 |
9.2SO2(g)+O2(g)?2SO3(g),是工业制硫酸的重要反应,下列关于该反应的说法不正确的是( )
| A. | 使用催化剂可增大该反应速率 | |
| B. | 增大O2的浓度能加快反应速率 | |
| C. | 该反应达到平衡时,正、逆反应速率相等但不为0 | |
| D. | 一定条件下,2 mol SO2和1 mol O2反应可以得到2 mol SO3 |
16.下列离子方程式正确,且与所述事实相符的是( )
| A. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | 向水中通氯气:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 在强碱溶液中,次氯酸钠与Fe(OH)3 反应生成Na2FeO4,离子方程式:3ClO-+2Fe(OH)3═2FeO42-+H2O+3Cl-+4H+ |
10.已知在100℃时,水的离子积常数Kw=1×10-12,在100℃时,下列说法正确的是( )
| A. | 0.005mol/L的Ba(OH)2溶液,pH=10 | |
| B. | 0.001mol/L的CH3COOH溶液,pH=3 | |
| C. | 0.005mol/L的H2SO4溶液与0.01mol/L的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50ml,需要pH=9的NaOH溶液100ml |
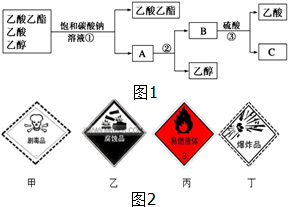 (1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.
(1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.
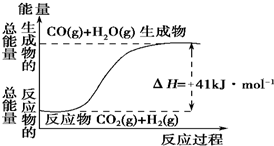 (1)根据如图所示情况,判断下列说法中正确的是B.
(1)根据如图所示情况,判断下列说法中正确的是B.