��Ŀ����
8���⻯ﮣ�LiH��Ϊ����״��ɫ�����壬��������������������Դ�����ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ�ij�С����ʹ������װ���Ʊ�LiH���壮��ͬѧ��ʵ�鷢�����£�
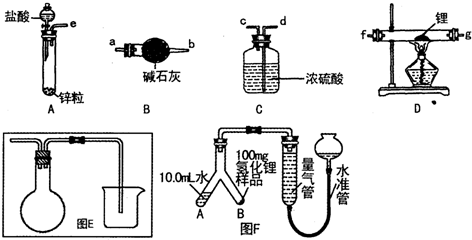
��1����������������װ���ӣ���������װ�ýӿڵ�����˳��Ϊe��a��b��f��g��d������װ��B�������dz�ȥ�����е�ˮ���Ȼ��⣮
��2������ҩƷ�������Ӵ��Լ�ƿ��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ��IJ�����Ŀ���dz�ȥﮱ����ʯ����Ȼ����ٰ�﮷ŵ�ʯӢ���У�����һ��ʱ���ֹͣ���ȣ�����ͨ������ȴ��Ȼ��ȡ��LiH��װ�뵪���ƿ������ڰ�����
��3����ͬѧ�Լ�ʹ�÷���������ɣ�����Ϊδ��Ӧ��H2����ֱ���ŷţ����������������װ��E�����ռ�H2���뽫ͼEװ�ò���������
����Ʒ�Ķ����ⶨ��
ͨ����ʾ�����Ƶõ��⻯���Ʒ�г�����δ��ȫ��Ӧ��ﮣ�������ܵ����ʺ��Բ��ƣ�����Ʒ���ȵIJⶨ�ٲ������£���
�ټ��װ�������ԣ�װ��ҩƷ����ͼF���̶�װ��ʡ�ԣ���ʾ��������
�ڵ���ˮ�ܸ߶ȣ�ʹ����װ�����ߵ�Һ�汣��ͬһˮƽ����ȡ������Һ�����ڵĿ̶�����Ϊ10.0mL��
�۽�Y�ι�������б��ֱ��A�˵�ˮȫ����B�˵���Ʒ��ϣ�
�ܷ�Ӧ��������ȴ�����£��ٴζ�ȡ������Һ�����ڿ̶�����Ϊ254.4mL��
�ش��������⣺
��4������ж���Ʒ��ˮ��ȫ��Ӧ�����ݲ��ٲ������ұߵ���������Һ�棬�����ٱ仯��
��5����Ӧ�������������Ϊ244.4mL��
��6����֪�������£��������ܶ�Ϊ0.09mg/ml������Ʒ���⻯﮵Ĵ��ȣ�
���� ��1���Ʊ�LiH������Ҫ�Ʊ�������﮷�����Ӧ��LiH�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ������Ʊ��õ�������������﴿��������Aװ���Ʊ�������������B�еļ�ʯ�ҳ�ȥ�����е��Ȼ����ˮ������ͨ��װ��D�м��Ⱥ�﮷�Ӧ�����⻯ﮣ��������װ��C��ֹ�����е�ˮ�����Ͷ�����̼����װ��D�����ɵ��⻯﮷�����Ӧ��
��2��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ�����ʯ�����л������ܽ����л��ܼ��ױ��з�����
��3��װ��E�����ռ�H2�����õ�������ƿ���ռ����������Ը�����ˮ���������װ�ã������ܶ̽�������
��4������װ���ص���⻯����ˮ��Ӧ�����������з�����
��5��������������ڷ�Ӧǰ��Һ��
��6����������������=������������������ܶ�����������������ٽ���⻯���ˮ��Ӧ����ʽ�����ˮ��Ӧ����ʽ������⻯﮵�����������������Ʒ���⻯﮵Ĵ��ȣ�
��� �⣺��1���Ʊ�LiH������Ҫ�Ʊ�������﮷�����Ӧ��LiH�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ������Ʊ��õ�������������﴿��������Aװ���Ʊ�������������B�еļ�ʯ�ҳ�ȥ�����е��Ȼ����ˮ������ͨ��װ��D�м��Ⱥ�﮷�Ӧ�����⻯ﮣ��������װ��C��ֹ�����е�ˮ�����Ͷ�����̼����װ��D�����ɵ��⻯﮷�����Ӧ��װ������˳��Ϊ��e��a��b��f��g��d��װ��B�м�ʯ���������ƺ��������ƵĻ�����������ˮ�ɷ�Ӧ���������ƿ�������������������ܷ�Ӧ�����Ը�װ�õ�����������ˮ�����Ͳ����Ȼ������壬
�ʴ�Ϊ��e��a��b��f��g��d����ȥ�����е�ˮ���Ȼ��⣻
��2��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ�����ʯ�����л������ܽ����л��ܼ��ױ��У�������Ŀ���dz�ȥﮱ����ʯ����
�ʴ�Ϊ����ȥﮱ����ʯ����
��3��װ��E�����ռ�H2�����õ�������ƿ���ռ����������Ը�����ˮ���������װ�ã������ܶ̽�������װ��ͼΪ ��
��
�ʴ�Ϊ�� ��
��
��4�������⻯����ˮ��Ӧ���������������ж���Ʒ��ˮ�Ƿ���ȫ��Ӧ�����Թ۲����ݲ��ٲ������ұߵ���������Һ�棬�����ٱ仯��������ȫ��Ӧ��
�ʴ�Ϊ�����ݲ��ٲ������ұߵ���������Һ�棬�����ٱ仯��
��5��������������ڷ�Ӧǰ��Һ���=254.4mL-10.0mL=244.4mL���ʴ�Ϊ��244.4��
��6����Ӧ������������=244.4ml��0.09mg/ml=21.996mg���⻯���Ʒ�г�����δ��ȫ��Ӧ��ﮣ�
��LiH������ΪX��������������ΪY����﮵�����=100mg-X�����ˮ��Ӧ������������Ϊ21.996mg-Y
LiH+H2O=H2��+LiOH
8 2
X Y
X=4Y
2Li+2H2O=2LiOH+H2��
14 2
100mg-X 21.996mg-Y
2��100mg-X��=14��21.996mg-Y��
���X=71.96mg
Y=17.99mg
��Ʒ���⻯﮵Ĵ���=$\frac{71.96mg}{100mg}$��100%=71.96%��
����Ʒ���⻯﮵Ĵ���Ϊ71.96%��
���� ���⿼����������ɵ�ʵ��̽�����������̷����жϣ�ʵ��װ�õ�����˳��ͷ����жϣ���ѧ����ʽ���������Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

��H��2H��3HΪ���ֲ�ͬ�ĺ��أ�
��H��2H��3H��Ϊͬλ�أ�
��H��2H��3H��Ϊͬ�������壻
��114��Ԫ��λ�����ڱ���������VA�壻
����Ԫ��������Ϊ1��
��ͬλ�صġ�ͬλ��ָ���ص���������ͬ����Ԫ�����ڱ���ռ��ͬ��λ�ã�
��Ϊͬλ�ص�ԭ���������ʡ���ѧ���ʾ���ͬ��
| A�� | �٢ڢޢ� | B�� | �٢ڢۢ� | C�� | �٢ڢ� | D�� | �٢ڢۢޢ� |
| A�� | AlN��ͨ����ӦAl2O3+N2+3C$\frac{\underline{\;����\;}}{\;}$2AlN+3CO�ϳɣ��÷�Ӧ�У�ÿ����1 mol AlN��ת��1.5 mol���� | |
| B�� | CsICl2��һ�ּ�����Ķ�±������������ڻ�ѧ��Ӧ�мȿɱ����������ֿɱ��ֻ�ԭ�ԣ�����CsICl2��Һ��ͨ��Cl2���е��ʵ����� | |
| C�� | ��ӦA+3B�T2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��v��A��=0.15 mol/��L•s������v��B��=0.6 mol/��L•s������v��C��=0.4 mol/��L•s������v��D��=0.45 mol/��L•s�����÷�Ӧ���еĿ���˳��Ϊ�ܣ���=�ڣ��� | |
| D�� | AlCl3��Һ�м������ϡ��ˮ����Ӧ�����ӷ���ʽΪ��Al3++4NH3•H2O�TAlO2-+4NH4++2H2O |
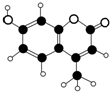 ij�ּ���Ⱦ�ϣ�Ӧ���ڿɵ�гȾ�ϼ�����������C��H��O����Ԫ����ɣ��������ģ����ͼ��ʾ�������й�������ȷ���ǣ�������
ij�ּ���Ⱦ�ϣ�Ӧ���ڿɵ�гȾ�ϼ�����������C��H��O����Ԫ����ɣ��������ģ����ͼ��ʾ�������й�������ȷ���ǣ��������ٷ���ʽΪC10H9O3
��1mol���л���������ˮ��3mol�巢��ȡ����Ӧ
�۸����ʺ���3�ֹ�����
����ʹ����KMnO4��Һ��ɫ��
| A�� | �ۢ� | B�� | �٢� | C�� | �ڢۢ� | D�� | �٢ڢۢ� |
| �� ���� | IA | 0 | ||||||
| 1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
��2���ڡ��ۡ��ߵ���ۺ������������ǿ������˳����HNO3��H2CO3��H2SiO3��
��3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ��
 ��
��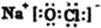 ���ɢڡ�������Ԫ���γɵ�һ��������������ЧӦ�������ʽΪ��
���ɢڡ�������Ԫ���γɵ�һ��������������ЧӦ�������ʽΪ��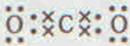 ��
����4�������ֻ�������ɢ١��ܡ��ݡ�������Ԫ���γɣ�����֮������������ѧ��Ӧ�������ӷ�Ӧ����ʽΪ��HSO3-+H+=H2O+SO2����
��5���ɱ���Ԫ���γɵij�������X��Y��Z��M��N�ɷ������·�Ӧ��
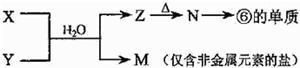
X��Һ��Y��Һ��Ӧ�����ӷ���ʽΪAl3++3NH3+3H2O=Al��OH��3��+3NH4+��
N���ĵ��ʵĻ�ѧ����ʽΪ2Al2O3�����ڣ�$\frac{\underline{\;\;\;���\;\;\;}}{����ʯ}$4Al+3O2����
��1��ʵ�����ϱ��д�С�����ձ�����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β����������0.50mol•L-1NaOH��Һ��0.55mol•L-1���ᣬʵ����ȱ�ٵIJ�����������Ͳ���¶ȼƣ�
��2��ʵ�����ܷ��û���ͭ˿��������滷�β��������������ܡ���
��3�����Ǽ�¼��ʵ���������£�
| ʵ����Ʒ | ��Һ�¶� | �к��� | |||
| t1 | t2 | ��H | |||
| �� | 50 mL 0.50 mol•L-1 NaOH��Һ | 50 mL 0.55 mol•L-1 HCl��Һ | 20�� | 23.2�� | |
| �� | 50 mL 0.50 mol•L-1 NaOH��Һ | 50 mL 0.55 mol•L-1 HCl��Һ | 20�� | 23.4�� | |
��ͨ������õ��к��ȡ�H=-55.2kJ/mol������һλС������
�ڸ���ʵ����д��NaOH��Һ��HCl��Һ��Ӧ���Ȼ�ѧ����ʽ��HCl��aq��+NaOH��aq��=NaCl��aq��+2H2O��l����H=-55.2kJ/mol��
��4������0.60mol•L-1NaOH��Һ����0.50mol•L-1NaOH��Һ��ʵ�飬�Բⶨ����ޣ���С����ޡ�����ͬ��Ӱ�죻����0.55mol•L-1�������0.55mol•L-1������ʵ�飬�Բⶨ�����Ӱ�죮
��5�����������ֱ���ʵ��ⶨֵ����ȷֵ57.3kJ/mol��ƫ�����ƫ���ԭ������Ǣڢۣ�����ţ�������
����ȡNaOH��Һ�����ʱ���Ӷ���
�����¶ȼƲⶨNaOH��Һ���¶Ⱥ�ֱ�Ӳⶨ������¶�
�۷ֶ�ΰ�NaOH��Һ����װ�����С�ձ��У�

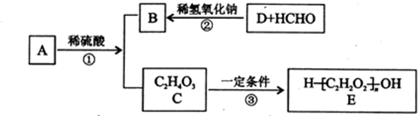
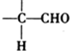 $\stackrel{ϡ����������Һ}{��}$
$\stackrel{ϡ����������Һ}{��}$ -CHO+
-CHO+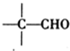 +NaOH��Ũ����
+NaOH��Ũ����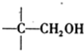 +
+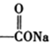
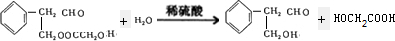
 ��
��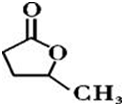 ��
��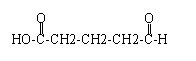 ��
��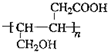 ��
��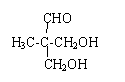 ��
��