题目内容
12.短周期元素X、Y、Z、W的原子序数依次增大.它们分别位于不同的主族,X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的相等,X与W所在族序数之和等于10.下列说法正确的是( )| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | W分别与X、Y形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | Z的简单氢化物的热稳定性比W的强 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,它们分别位于不同的主族,X的最高正价与最低负价代数和为0,X与W所在族序数之和等于10,则X处于ⅣA主族,W处于ⅥA族,结合原子序数可知,X为C元素、W为S元素,Y与Z最外层电子数之和与W的相等,即二者最外层电子数之和为6,又由于分别位于不同的主族,只能为IA、ⅤA族元素,结合原子序数,则Y为Na、Z为P元素,据此解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,它们分别位于不同的主族,X的最高正价与最低负价代数和为0,X与W所在族序数之和等于10,则X处于ⅣA主族,W处于ⅥA族,结合原子序数可知,X为C元素、W为S元素,Y与Z最外层电子数之和与W的相等,即二者最外层电子数之和为6,又由于分别位于不同的主族,只能为IA、ⅤA族元素,结合原子序数,则Y为Na、Z为P元素.
A.同周期自左而右原子半径减小、电子层越多原子半径越大,故原子半径:Y(Na)>Z(P)>W(S)>X(C),故A错误;
B.W分别与X、Y形成的化合物为CS2、Na2S,前者含有共价键,后者含有离子键,故B错误;
C.X、Z的最高价氧化物的水化物分别为碳酸、磷酸,碳酸酸性比磷酸弱,故C正确;
D.非金属性Z(P)<W(S),故氢化物稳定性PH3<H2S,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列离子方程式书写正确的是( )
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
7.下列物质性质与应用对应关系正确的是( )
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 碱石灰具有吸水性,可用于干燥氯气 | |
| C. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| D. | H2O2具有还原性,可用于与酸性高锰酸钾溶液反应制取少量氧气 |
16.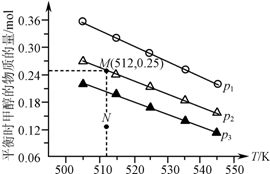 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512 K时,图中N点v(正)<v(逆) |
2.下列化合物中互为同系物的醇类是( )
| A. | CH3CH2OH与CH2=CHCH2OH | |
| B. | CH3OH与HO-CH2-CH2-OH | |
| C. | HO-CH2-CH2-OH与HO-CH2-CH2-CH2-OH | |
| D. |  与 与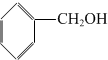 |
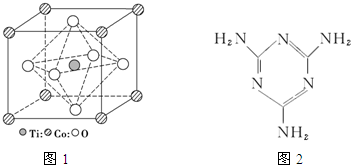 MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
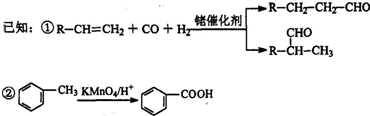


 .
.



 将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应器,在 一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图.假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.03mol•L-1•min-1.
将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应器,在 一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图.假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.03mol•L-1•min-1.