题目内容
6.某研究性学习小组设计了一组实验,验证元素周期律.(1)甲同学在a、b、c、d四只烧杯里分别加入50mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象.
①甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性逐渐减弱;
②反应最剧烈的烧杯里金属是D(填字母)A、钠 B、镁 C、铝 D、钾;
③写出a烧杯里发生反应的化学方程式2Na+2H2O=2Na++2OH-+H2↑.
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法BC
A.把镁、铝的金属块换成金属粉末 B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸 D.把烧杯中的冷水换成氢氧化钠溶液
⑤写出铝和盐酸反应的离子方程式2Al+6H+=2Al3++3H2↑.
分析 ①同一周期,从左到右,元素金属性逐渐减弱;
②金属性越强,单质与水反应越剧烈;
③钠与水反应生成氢氧化钠和氢气;
④反应现象不明显,说明反应速率小,根据影响速率的因素分析;
⑤铝与盐酸反应生成氯化铝和氢气.
解答 解:①同一周期,从左到右,原子失电子能力减弱,则元素金属性逐渐减弱;
故答案为:逐渐减弱;
②金属性K>Na>Mg>Al,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是D,
故答案为:D;
③钠与水反应生成氢氧化钠和氢气,则钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
④反应现象不明显,说明反应速率小,升高温度可以加快速率,所以把冷水换为热水,把水换为盐酸增大了溶液中氢离子的浓度,可以加快速率;
故答案为:BC;
⑤铝与盐酸反应生成氯化铝和氢气,其反应的离子方程式为:2Al+6H+=2Al3++3H2↑;
故答案为:2Al+6H+=2Al3++3H2↑.
点评 本题将元素及其化合物、元素周期律与实验知识结合起来,考查了金属元素性质的递变规律,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
16.在电冶铝的电解槽中存在电解质W3XZ6-XZ3-X2Y3,己知X、Y、Z、W四种元素的简单离子的电子层结构均相同.X原子最外层电子数等于电子层数,则下列说法正确的是( )
| A. | 原予序数:W>X>Y>Z | |
| B. | 原子半径:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 最高价氧化物对应的水化物碱性:w<x | |
| D. | 在电解过程中,W3XZ6的主要作用是增强电解质的导电性 |
17.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 18gD2O含有10NA个质子 | |
| C. | 标准状况下,2.24L CCl4中含有C-Cl 0.4 NA | |
| D. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA |
14.某有机物A的结构简式如图所示:下列叙述正确的是( )


| A. | 1molA最多可与4molBr2发生反应 | |
| B. | A分子中含有三类官能团 | |
| C. | 1molA与足量的NaOH反应,最多可以消耗3molNaOH | |
| D. | A的分子式为C13H15O4Cl |
1.元素在周期表中的位置,能反映原子结构和元素的化学性质,下列有关说法正确的是( )
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 由长、短周期元素共同组成的元素族称为主族 (除零族外) | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 互为同位素的不同核素,物理性质和化学性质都不同 |
11.乙醇分子中各化学键如右图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )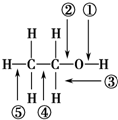

| A. | 和金属钠作用时,键①断裂 | |
| B. | 在铜催化下和氧气反应时,键①和③断裂 | |
| C. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| D. | 和乙酸、浓硫酸共热时,键②断裂 |
16.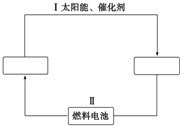 氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )
氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )
 氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )
氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )| A. | 氢能转化为化学能 | B. | 化学能转化为电能 | ||
| C. | 太阳能转化为热能 | D. | 电能转化为化学能 |
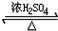 CH3COOCH2CH2CH3+H2O.
CH3COOCH2CH2CH3+H2O.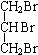 +3NaOH$→_{△}^{H_{2}O}$
+3NaOH$→_{△}^{H_{2}O}$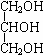 +3NaBr.
+3NaBr.
 四种有机物,且相对分子质量大小关系为B>C>D.则B、C、D 的结构简式分别是:
四种有机物,且相对分子质量大小关系为B>C>D.则B、C、D 的结构简式分别是: ;CCH3COOH;DHCOOH.
;CCH3COOH;DHCOOH. .
. .
.