题目内容
1. 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体(填“晶体”或“非晶体”).
(2)基态铜原子的核外电子排布式为1s22s22p63s23p63d104s1;在CuSO4溶液中滴入过量氨水,形成配合物的颜色为深蓝色.
(3)铜能与类卤素(SCN)2 反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2 对应的酸有两种,理论推测硫氰酸(H-S-C三N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键.
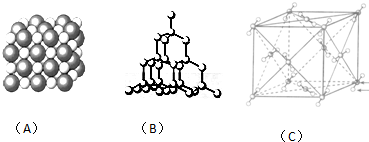
(4)金属锌晶体的堆积方式为六方最密堆积.在ZnS晶胞中(结构如图1所示),S2-的配位数为4.
(5)铜有两种氧化物CuO、Cu2O,高温时易转化为Cu2O的原因为Cu2O中Cu的d轨道为全充满状态,较稳定.(请从原子结构的角度解释)
(6)锕与金形成的金属互化物结构如图2所示,其晶胞边长为pm,该金属互化物的密度为$\frac{389×1{0}^{-30}}{{N}_{A}{a}^{3}}$g•cm-3.(用含a、NA的代数式表示)
分析 (1)晶体中原子排列有序,具有自范性;
(2)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;根据铜氨络离子的颜色分析;
(3)(SCN)2的结构式为N≡C-S-S-C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键;异硫氰酸分子间可形成氢键,沸点较高;
(4)Cu的晶体堆积方式属于Mg型为六方最密堆积;根据S2-离子周围距离最近的Zn2+数目判断;
(5)CuO中的Cu显+2价,它的价电子排布式为3d9,Cu2O中的Cu显+1价,它的价电子排布式为3d10,处于全充满状态时较稳定;
(6)利用均摊法求出晶胞中Cu、Au的个数,然后求出晶胞的质量,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)晶体中原子排列有序,具有自范性,已知某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体;
故答案为:晶体;
(2)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,在CuSO4溶液中滴入过量氨水,形成配合物铜氨络离子,铜氨络离子在溶液中为深蓝色;
故答案为:1s22s22p63s23p63d104s1;深蓝色;
(3)(SCN)2的结构式为N≡C-S-S-C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键,(SCN)2分子含有5个σ键,故1mol(SCN)2分子中含有σ键的数目为 5NA,
由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:5NA;异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;
(4)Cu的晶体堆积方式属于Mg型为六方最密堆积;由图1可知,S2-离子周围距离最近的Zn2+有4个,则S2-的配位数为4,
故答案为:六方最密堆积;4;
(5)CuO中的Cu显+2价,它的价电子排布式为3d9,Cu2O中的Cu显+1价,它的价电子排布式为3d10所以Cu2O中Cu的d轨道为全充满状态,较稳定,所以CuO高温易转化为Cu2O.
故答案为:Cu2O中Cu的d轨道为全充满状态,较稳定;
(6)晶胞中Cu原子数目为6×$\frac{1}{2}$=3、Au原子数目为8×$\frac{1}{8}$=1,晶胞质量为$\frac{3×64+197}{{N}_{A}}$g,晶胞边长为a pm=a×10-10 cm,则晶胞体积为(a×10-10 cm)3,
该金属互化物的密度为ρ=$\frac{m}{V}$=$\frac{3×64+197}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{389×1{0}^{-30}}{{N}_{A}{a}^{3}}$g•cm-3,
故答案为:$\frac{389×1{0}^{-30}}{{N}_{A}{a}^{3}}$.
点评 本题考查较综合,涉及电子排布、共价键键、晶胞计算、晶体沸点比较等,侧重原子结构与性质的考查,题目难度中等,注意把握常见的晶体堆积模型以及晶胞的有关计算.

| A. | 金属性保持不变 | B. | 非金属性逐渐增强 | ||
| C. | 金属性逐渐增强 | D. | 非金属性保持不变 |
| A. | 原予序数:W>X>Y>Z | |
| B. | 原子半径:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 最高价氧化物对应的水化物碱性:w<x | |
| D. | 在电解过程中,W3XZ6的主要作用是增强电解质的导电性 |
| A. | 福尔马林可用作食品防腐剂 | |
| B. | 苯酚皂可用于环境消毒,医用酒精可用于皮肤消毒,其原因是它们都可以杀死细菌 | |
| C. | “乙醇汽油”是在汽油中加入乙醇生成的一种新化合物 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| A. | 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 | |
| B. | 提纯液体混合物常用重结晶法 | |
| C. | 萃取是利用溶质在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂的操作 | |
| D. | 蒸馏时冷凝水的通水方向下进上出 |
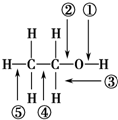
| A. | 和金属钠作用时,键①断裂 | |
| B. | 在铜催化下和氧气反应时,键①和③断裂 | |
| C. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| D. | 和乙酸、浓硫酸共热时,键②断裂 |
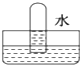
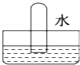
 利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化):
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化):