题目内容
18. X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:(1)上述五种元素中电负性最大的是O(填元素符号,下同),Y的第一电离能大于Z的第一电离能原因N原子2p轨道半充满,相对稳定;
(2)XW2的电子式为
 ;
;(3)Q的价电子排布式为3d54s2,Y3-的立体构型为直线.
(4)下列关于WZ2结构的说法正确的是D
A.WZ2为直线型非极性分子 B.WZ2为直线型极性分子
C.WZ2中W为sp3杂化 D.WZ2中W为sp2杂化
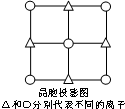
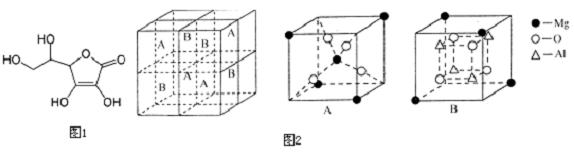
(5)α-QW晶胞的侧面投影图如图所示,已知每个晶胞中含Q、W离子数个4个,与Q离子最近且距离相等的W离子构成的几何图形是正八面体,用X射线衍射法测得该晶胞边长a=520.0pm,该晶体的密度为4.1g/cm3.
分析 元素W的原子序数等于元素Z的原子序数加8,说明二者同主族;XW2分子与Y3为等电子体,即价电子数相同,由于W与Z同主族,且Z原子序数小于W,故可推断出X、Y、Z为相邻元素,分别为C元素、N元素和O元素,W为S元素;N和S2-最外层电子数之和为13,Q的最外层电子数为2,Q原子序数为25,为Mn元素,
(1)元素周期表中,同主族元素从上到下元素的电负性逐渐减小,同周期从左到右,电负性逐渐增大,N元素的第一电离能较大,与核外电子排布有关;
(2)XW2为二氧化碳,为共价化合物;
(3)Q原子序数为25,为Cr元素,结合等电子体判断;
(4)WZ2结构为SO2,为极性分子,中心原子形成2个σ键,孤电子对数为$\frac{1}{2}$(6-2×2)=1;
(5)S2-位于面心,则Mn2+位于棱心,可形成正八面体;已知每个晶胞中含Q、W离子数个4个,则晶胞的质量为m=ρV,据此计算.
解答 解:元素W的原子序数等于元素Z的原子序数加8,说明二者同主族;XW2分子与Y3为等电子体,即价电子数相同,由于W与Z同主族,且Z原子序数小于W,故可推断出X、Y、Z为相邻元素,分别为C元素、N元素和O元素,W为S元素;N和S2-最外层电子数之和为13,Q的最外层电子数为2,Q原子序数为25,为Mn元素,
(1)电负性同一周期,从左到右逐渐增大,所以O>N>C,O、S位于同主族,电负性O>S,则最大的为O,由于N原子2p轨道半充满,相对稳定,则第一电离能大于O的第一电离能,
故答案为:O;N原子2p轨道半充满,相对稳定;
(2)CS2为直线型,符合8电子稳定结构,电子式为 ,故答案为:
,故答案为: ;
;
(3)Mn原子序数为25,内层电子排布式与Ar相同,外层电子排布式为:3d54s2,CS2分子与N3-为等电子体,其空间构型和化学键类型相同,空间构型为直线型,
故答案为:3d54s2;直线;
(4)WZ2结构为SO2,为极性分子,中心原子形成2个σ键,孤电子对数为$\frac{1}{2}$(6-2×2)=1,为V形的极性分子,为sp2杂化,故答案为:D;
(5)根据晶胞结构可知,与Q离子距离最近且距离相等的W离子是6个,构成的几何图形是正八面体,
晶胞中含有4个锰离子和4个硫离子,则晶胞的式量为:55×4+32×4=348,
1mol晶胞的质量为:ρ•V•NA=ρ×6.02×1023×(520×10-10)3=348,解得ρ=4.1g/cm3,
故答案为:正八面体;4.1.
点评 本题考查利用原子结构来推断元素,然后结合元素化合物知识及基本概念和基本理论来解答,注重了对高考热点的考查,并学会利用类推的方法来解题.

| 实验操作及现象 | 实验结论 | |
| A | 将SO2通入品红溶液中,红色逐渐褪去;再加热已褪色的溶液,溶液又恢复为红色 | 生成的亚硫酸不稳定 |
| B | 向某盐溶液中加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色 | 原溶液中含有NH+4 |
| C | 在某硝酸盐溶液中加入少量稀H2SO4,酸化,再滴加几滴KSCN溶液,溶液变红色 | 原硝酸盐为Fe(NO3)3 |
| D | 将淀粉液和稀硫酸混合微热:一段时间后加入银氨溶液,振荡,水溶加热,试管内壁未出现银镜 | 淀粉一定尚未水解 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 化学键 | B. | 中心原子杂化类型 | ||
| C. | 分子构型 | D. | 分子间作用力 |
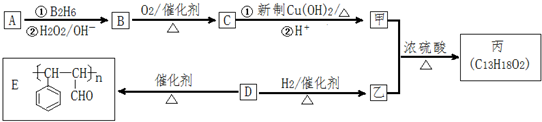
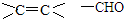 .
. (CH3)2CHCOONa+Cu2O↓+3H2O.
(CH3)2CHCOONa+Cu2O↓+3H2O.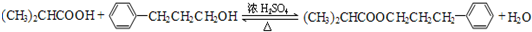 .
.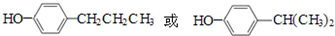 .
.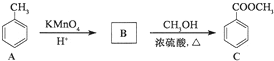
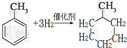 ,反应类型为加成反应.
,反应类型为加成反应.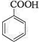 ,所得B的粗产品通常用重结晶的方法提纯.
,所得B的粗产品通常用重结晶的方法提纯.
 →CH3-CHO+H2O
→CH3-CHO+H2O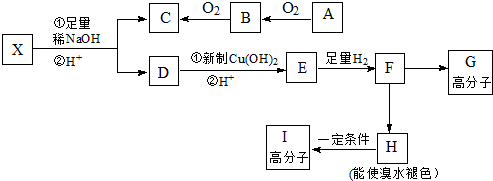
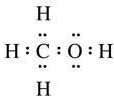 .
. ;
;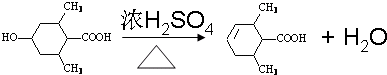 ;
;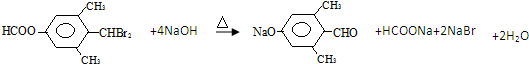 ;
;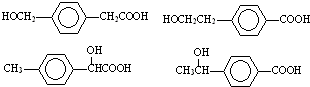 任意一种.
任意一种.