题目内容
20.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的2.5倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )| A. | 元素X的简单气态氢化物的热稳定性性比W的弱 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| C. | 原子半径的大小顺序:rY>rz>rw>rx | |
| D. | 元素Y、Z的氧化物中化学键的类型相同 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的2.5倍,X有2个电子层,最外层电子数为5,故X为N元素;W与X属于同一主族,故W为P元素;Y原子的最外层只有2个电子,原子序数大于N元素,故Y处于第三周期,故Y为Mg元素;Z单质可制成半导体材料,Z为Si元素,据此解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的2.5倍,X有2个电子层,最外层电子数为5,故X为N元素;W与X属于同一主族,故W为P元素;Y原子的最外层只有2个电子,原子序数大于N元素,故Y处于第三周期,故Y为Mg元素;Z单质可制成半导体材料,Z为Si元素.
A.同主族自上而下非金属性减弱,氢化物稳定性与元素非金属性一致,故氢化物稳定性NH3>PH3,故A错误;
B.同周期自左而右元素非金属性增强,最高价含氧酸的酸性增强,即酸性:磷酸>硅酸,故B错误;
C.同周期自左而右原子半径减小,同主族电子层越多原子半径越大,故原子半径Mg>Si>P>O,即原子半径rY>rz>rw>rx,故C正确;
B.化合物MgO为离子化合物,含有离子键,SiO2属于共价化合物,含有共价键,故D错误;
故选:C.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,推断元素是解题的关键,注意对基础知识的全面掌握.

练习册系列答案
相关题目
10.某同学设计了由乙醇合成乙二醇的路线如下.下列说法正确的是( )
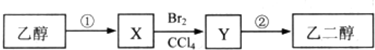

| A. | 等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同 | |
| B. | 步骤②需要在氢氧化钠醇溶液中反应 | |
| C. | 步骤①的反应类型是水解反应 | |
| D. | X可以发生加成反应 |
15.下列反应中,属于取代反应的是( )
| A. | CH4$\stackrel{高温}{→}$C+2H2 | |
| B. | CH3CH=CH2+Br2$\stackrel{CCl_{4}}{→}$CH3CHBrCH2Br | |
| C. | CH+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |
5.下列属于取代反应的是( )
| A. | 甲烷燃烧 | |
| B. | 在镍催化下苯与氢气反应生成环己烷 | |
| C. | 乙烯使溴水褪色 | |
| D. | 光照条件下甲烷与氯气反应生成一氯甲烷 |
12.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HCl04>HBr04>HI04 | B. | 碱性:Na0H>Mg(0H)2>Al(0H)3 | ||
| C. | 稳定性;PH3>H2S>HCl | D. | 非金属性:F>0>S |
10.硫晶体熔化或气化时,下述各项中发生变化的是( )
| A. | 化学键 | B. | 中心原子杂化类型 | ||
| C. | 分子构型 | D. | 分子间作用力 |
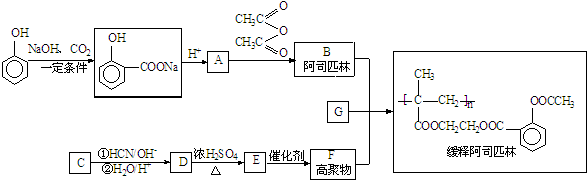
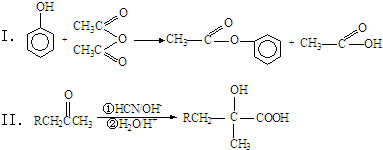
 ,写出E→F的反应类型加聚反应.
,写出E→F的反应类型加聚反应.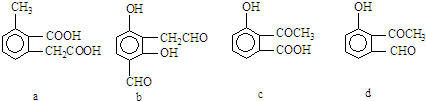
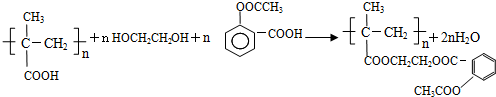 .
.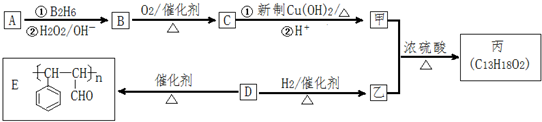
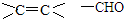 .
. (CH3)2CHCOONa+Cu2O↓+3H2O.
(CH3)2CHCOONa+Cu2O↓+3H2O.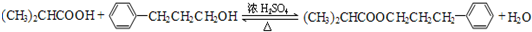 .
.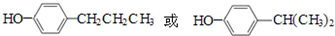 .
.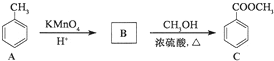
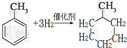 ,反应类型为加成反应.
,反应类型为加成反应.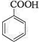 ,所得B的粗产品通常用重结晶的方法提纯.
,所得B的粗产品通常用重结晶的方法提纯.