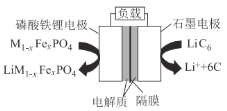
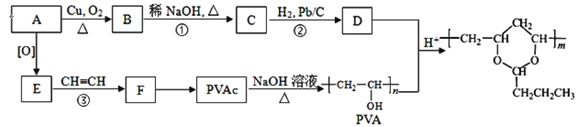
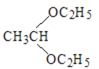
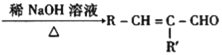题目内容
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1 = 1.1×10-5 ,Ka2 = 1.3×10-8。下列叙述正确的是( )
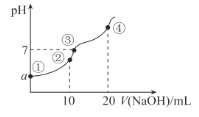
A.从点①到点④过程中水的电离程度先增大后减小
B.点②处c(Na+) + 2c(H+) + c(H2X) =2 c(X2-) + c(HX-) + 2c(OH-)
C.a近似等于3
D.点④处c(Na+) = 2 c(X2-) > c(OH-) > c(HX-) > c(H+)
【答案】C
【解析】
A.点④时H2X与NaOH恰好完全反应生成Na2X,Na2X是强碱弱酸盐,此时水的电离程度最大,A错误;
B.点②时H2X与NaOH恰好完全反应生成NaHX,由电荷守恒可知,①式c(Na+) + c(H+)=2 c(X2-) + c(HX-) + c(OH-),由物料守恒可知,②式c(Na+) = c(X2-) + c(HX-) + c(H2X),两式结合得:③式c(H+)+ c(H2X)= c(X2-) + c(OH-),①+③得:c(Na+) + 2c(H+) + c(H2X) =2 c(X2-) + 2c(OH-),B错误;
C.H2X是一个二元弱酸,以第一步电离为主,H2X![]() H++ HX-,故Ka1 = c(H+)×c(HX-)/ c(H2X) = c2(H+)/(0.1mol/L)= 1.1×10-5,c(H+)
H++ HX-,故Ka1 = c(H+)×c(HX-)/ c(H2X) = c2(H+)/(0.1mol/L)= 1.1×10-5,c(H+) ![]() 10-3 mol/L,故pH约为3,C正确;
10-3 mol/L,故pH约为3,C正确;
D.点④时H2X与NaOH恰好完全反应生成Na2X,Na2X是强碱弱酸盐,X2-在溶液中水解,故c(Na+) >2 c(X2-) ,D错误;
答案选C。

【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
【题目】常温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp |
|
|
|
|
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜先加入_______(填试剂分子式),然后调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。
(2)在有CuCl与CuI固体共存的悬浊液中,C(Cl-)______C(I-)(填 > < =)
某溶液中C(Cl-)为0.0001 mol·L-1, C(I-)为0.1 mol·L-1,往溶液中滴加硝酸亚铜,先产生的沉淀是__________(填沉淀化学式)