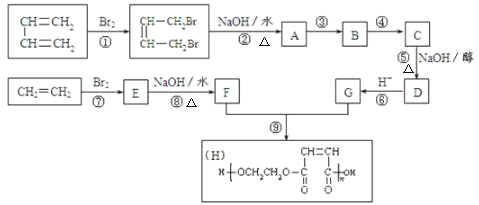
题目内容
【题目】物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
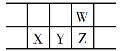
B. 两溶液中氢氧根离子浓度均为![]()
C. 加入醋酸钠固体,二者的pH均增大
D. 恰好完全反应时,两溶液消耗等浓度等体积的氢氧化钠
【答案】C
【解析】
A. 盐酸是强酸,HCl完全电离,醋酸是弱酸,部分电离,所以0.1 mol/L的盐酸和醋酸溶液中醋酸溶液反应慢,故A错误;B.盐酸是强酸,完全电离,氢离子浓度为0.1mol/L,所以氢氧根离子浓度为10-13 mol/L,醋酸是弱酸,部分电离, 氢离子浓度小于0.1mol/L,氢氧根离子浓度大于10-13 mol/L,故B错误;C. 向盐酸中加入醋酸钠晶体,醋酸钠和盐酸反应生成醋酸,导致溶液的pH增大,向醋酸中加入醋酸钠,能抑制醋酸电离,导致其溶液的pH增大,故C正确;D.酸的浓度相同,但是体积大小不知,无法比较消耗氢氧化钠的多少,故D错误;答案:C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目