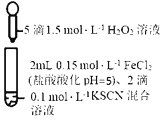题目内容
【题目】某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:
① | ② | ③ |
|
|
|
溶液变红,约10秒后红色褪去,产生能使带火星木条复燃的气体,取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀 | 溶液变红且不褪色,有能使带火星木条复燃的气体产生,产物经检验有丁达尔效应 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,产物经检验无丁达尔效应 |
下列说法错误的是
A.②中红色溶液中含有Fe(OH)3胶体
B.实验②中发生的氧化还原反应只有两种
C.对比①②,可以判定酸性条件下H2O2可以氧化SCN-
D.③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O
【答案】B
【解析】
A项、由实验②的实验现象可知,产物经检验有丁达尔效应,说明酸性条件下H2O2将Fe2+氧化为Fe3+,Fe3+水解形成红色Fe(OH)3胶体,故A正确;
B项、由实验②的实验现象可知,实验中存在的反应有酸性条件下H2O2将Fe2+氧化为Fe3+、在Fe3+做催化剂作用下,双氧水分解生成水和氧气,由实验①的实验现象可知,实验中还存在的反应还有酸性条件下H2O2可以氧化部分SCN-,三个反应均属于氧化还原反应,故B错误;
C项、对比实验①②的实验现象可知,酸性条件下H2O2可以氧化SCN-,生成的硫酸根与氯化钡溶液反应生成白色沉淀,故C正确;
D项、由实验③的实验现象可知,酸性条件下,O2将Fe2+氧化为Fe3+,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,故D正确;
故选B。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向苯酚钠溶液中滴加NaHSO3溶液,溶液变浑浊 | 苯酚酸性弱于H2SO3酸性 |
B | 向AgNO3溶液中逐滴加入浓度均为0.05 mol·L-1的NaI、NaCl混合溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
C | 向FeCl3溶液中加入Cu粉,Cu粉溶解 | Cu的还原性大于Fe |
D | 向盛有H2O2溶液的试管中滴几滴酸化的FeCl2溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现 | 铁离子催化H2O2的分解 |
A.AB.BC.CD.D