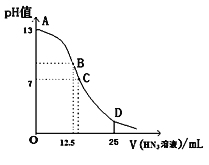
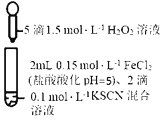��Ŀ����
����Ŀ��A���������������������������մɲ��ϣ�A������Ԫ����ɣ�ȡ2.05g A�ڴ����г�ַ�Ӧ���õ�2.55g����E��һ������G��һ�������£�A����������ͼ��ʾ������ת����ϵ������C��F��K����ɫ��ζ�����嵥�ʣ�D��H�ǹ��嵥�ʡ���Ӧ�ڳ���������β���Ĵ�����
(1)C�ĵ���ʽ_________��
(2)A������Ԫ���γɵĶ��ּ����ӵİ뾶_______����_______���������ӷ��ţ�
(3)��Ӧ�ڵĻ�ѧ����ʽ_______________________��
(4)д����Ӧ�ܵ����ӷ���ʽ_______________________��
(5)A�ڳ�ʪ�Ŀ����ﲻ�ȶ�������һ�ִ̼�����ζ�����壬д����Ӧ�Ļ�ѧ����ʽ_____________��
���𰸡�![]() N3- Al3+ 2NO+2CO
N3- Al3+ 2NO+2CO![]() N2+2CO2 2Al+2OH��+2H2O=2AlO2��+3H2�� AlN+3H2O=Al(OH)3+NH3��
N2+2CO2 2Al+2OH��+2H2O=2AlO2��+3H2�� AlN+3H2O=Al(OH)3+NH3��
��������
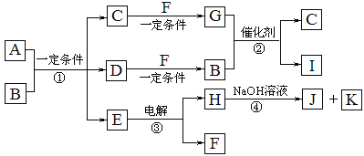
�����£�C��F��M����ɫ��ζ�����嵥�ʣ����߷ֱ�ΪH2��N2��O2�е�һ�֣����õ�H��F��H���嵥�ʣ�����NaOH��Һ��Ӧ����J��K��JΪNaAlO2��KΪH2����֪EΪAl2O3��HΪAl��FΪO2����Ӧ�ڳ���������β���Ĵ�����B��G������β���е���Ҫ��Ⱦ���壬����β������ԭ������CO+2NO![]() CO2+N2�����D�ǹ��嵥�ʣ���֪D��C���ʣ�B��CO��G��NO�� C��F�ڷŵ������µõ�GΪNO��CΪN2��IΪCO2�� A���������������������������մɲ��ϣ�A������Ԫ����ɣ���CO��Ӧ�٣�����N2��C��Al2O3������Ԫ���غ㣬���Ԫ�ص�ԭ�ӽṹ��֪AΪAlN���Դ˽����⡣
CO2+N2�����D�ǹ��嵥�ʣ���֪D��C���ʣ�B��CO��G��NO�� C��F�ڷŵ������µõ�GΪNO��CΪN2��IΪCO2�� A���������������������������մɲ��ϣ�A������Ԫ����ɣ���CO��Ӧ�٣�����N2��C��Al2O3������Ԫ���غ㣬���Ԫ�ص�ԭ�ӽṹ��֪AΪAlN���Դ˽����⡣
��������������֪��A��AlN��B��CO��C��N2��D��C���ʣ�E��Al2O3��F��O2��G��NO��H��Al��I��CO2��J��NaAlO2��K��H2��
(1)C��N2������Nԭ�ӹ������Ե��ӣ�ʹÿ��Nԭ�Ӷ��ﵽ�ȶ��ṹ�����N2�ĵ���ʽΪ![]() ��
��
(2)A��AlN����������Ԫ���γɵĶ��ּ�����N3-��Al3+�ĵ��Ӳ��Ų�����2��8�����ڵ��Ӳ�ṹ��ͬ��������˵���˵����Խ�����Ӱ뾶��ԽС���������Ӱ뾶N3-����Al3+��
(3)��Ӧ����CO��NO�ڴ����ͼ���ʱ��Ӧ����������CO2��N2���÷�Ӧ�Ļ�ѧ����ʽ��2NO+2CO![]() N2+2CO2��
N2+2CO2��
(4)Al������ǿ��NaOH��Һ������Ӧ������NaAlO2����������Ӧ�ܵ����ӷ���ʽ��2Al+2OH��+2H2O=2AlO2��+3H2����
(5) AlN�����������Σ��ڳ�ʪ�Ŀ�����������е�ˮ����������Ӧ������һ�ִ̼�����ζ������NH3��Al(OH)3���÷�Ӧ�Ļ�ѧ����ʽ��AlN+3H2O=Al(OH)3+NH3����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��Na��Al��Fe��Cu����ѧ��ѧ����Ҫ�Ľ���Ԫ�ء����ǵĵ��ʼ��仯����֮���кܶ�ת����ϵ���±��������ʲ��ܰ���ͼ(��������ʾһ�����)��ϵ�ת������
ѡ�� | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
����Ŀ��ijͬѧ��KSCN��Һ��FeCl2��Һ̽��Fe2+�Ļ�ԭ��ʱ�����쳣����ʵ�����£�
�� | �� | �� |
|
|
|
��Һ��죬Լ10����ɫ��ȥ��������ʹ������ľ����ȼ�����壬ȡ��ɫ����Һ���μ������BaCl2��Һ��������ɫ���� | ��Һ����Ҳ���ɫ������ʹ������ľ����ȼ��������������ᆳ�����ж����ЧӦ | ��Һ����Ҳ���ɫ���μ������BaCl2��Һ���ް�ɫ���������ᆳ���������ЧӦ |
����˵���������
A.���к�ɫ��Һ�к���Fe(OH)3����
B.ʵ����з�����������ԭ��Ӧֻ������
C.�ԱȢ٢ڣ������ж�����������H2O2��������SCN-
D.���з�����������ԭ��ӦΪ��4Fe2++O2+4H+=4Fe3++2H2O
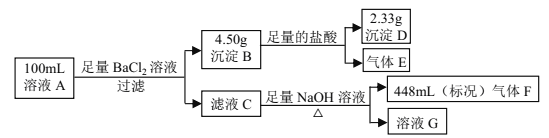
����Ŀ����ҵ��ˮ�н����±������е�5�֣�������ˮ�ĵ��뼰���ӵ�ˮ�⣩���Ҹ������ӵ����ʵ���Ũ�Ⱦ�Ϊ0.1 molL-1 ��
������ | K+��Cu2+��Fe3+��Al3+��Fe2+ |
������ | Cl-��CO32-��NO3-��SO42-��SiO32- |
ijͬѧ��̽���÷�ˮ����ɣ�����������ʵ�飺
��.�ò�˿պȡ������Һ���ڻ��������գ�����ɫ����(����ɫ�ܲ����۲죩��
��.ȡ������Һ������KSCN��Һ�����Ա仯��
��.��ȡ��Һ�����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����ʱ��Һ��Ȼ���壬����Һ������������䡣
��.������������Һ�м���BaCl2��Һ���а�ɫ�������ɡ�
��ش��������⣺
��1����ͬѧ����ȷ��ԭ��Һ�������������� _____________����������__________����д���ӷ��ţ�
��2�����м�����������������ɫ��������ӷ���ʽΪ___________________________��
��3�������к���ɫ���壨����£��ռ�һ���Թ�Ȼ����ˮ�У��������ʲ���ɢ����������Һ�����ʵ����ʵ���Ũ��Ϊ___________ molL-1 ����ȷ��С��������λ����
��4����ȡ100mLԭ��Һ������������NaOH��Һ����ַ�Ӧ����ˣ�ϴ�ӣ����������أ��õ��Ĺ��������Ϊ______g��