题目内容
可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件.函数△G就是制断的依据:△G=△H-T△S.式中T为反应的温度(开尔文温度,没有负值).
(1)当一个反应的△G 0(填“>”、“<”或“=”)时,反应一定能自发进行.
(2)为什么当△H<0,△S<0,温度 (填“较高”或“较低”)时能自发反应,理由是 ,试举一列,写出化学方程式 .
(1)当一个反应的△G
(2)为什么当△H<0,△S<0,温度
考点:反应热和焓变
专题:化学反应中的能量变化
分析:△G=△H-T△S<0时,反应能够自发进行,据此分析.
解答:
解:(1)△G=△H-T△S<0时,反应能够自发进行,故答案为:<;
(2)△H-T△S<0时,反应自发进行,当△H<0,△S<0,T较低时△G<0,反应能够自发进行,例如2H2+O2=2H2O的△H<0,△S<0,故答案为:较低;△H<0,△S<0,T较低时△G<0,反应能够自发进行;2H2+O2=2H2O.
(2)△H-T△S<0时,反应自发进行,当△H<0,△S<0,T较低时△G<0,反应能够自发进行,例如2H2+O2=2H2O的△H<0,△S<0,故答案为:较低;△H<0,△S<0,T较低时△G<0,反应能够自发进行;2H2+O2=2H2O.
点评:本题考查了反应自发进行的条件,即△H-T△S<0时,反应能够自发进行,题目难度不大.

练习册系列答案
相关题目
已知:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O,2FeCl2+Cl2=2FeCl3,下列物质的氧化性由强到弱的顺序是( )
| A、KMnO4>Cl2>FeCl3 |
| B、Cl2>KMnO4>FeCl3 |
| C、FeCl3>Cl2>KMnO4 |
| D、FeCl3>KMnO4>Cl2 |
对于主族元素R形成化合物的分子式为HROm,其水溶液呈酸性,下列说法中正确的是( )
| A、m越大,其HROm的氧化性越强 |
| B、m越大,其HROm的酸性越强 |
| C、与Zn反应时,只能产生一种气体 |
| D、当m=3时,R一定为ⅤA族 |
把铁片加到1L 1mol/L的氯化铁溶液中,当反应后溶液中Fe3+和Fe2+物质的量浓度相等时,铁片减少的质量为( )
| A、2.8g | B、5.6g |
| C、11.2g | D、1.4g |
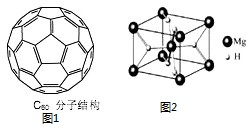 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.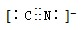
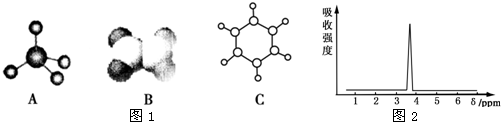
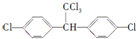 的有机物中,分子中最多有
的有机物中,分子中最多有 2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题:
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题: