题目内容
 2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题:
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题:(1)O、S、Se的电负性最小的是
(2)硒的低价含氧酸盐-亚硒酸钠(Na2SeO3),能促进细胞DNA的增殖活性,延缓细胞衰老,SeO32- 中的Se原子杂化方式是
(3)镉(Cd)与锌为同族相邻元素,在周期表中Cd位于
(4)锌单质晶体是六方最密堆积,原子按
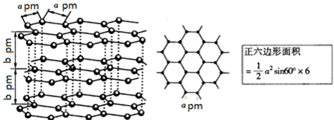
(5)镉和锌都是电的良导体,非金属晶体石墨也具有良好的导电性,如图为石墨晶体结构示意图及提供的资料,12g石墨晶体中正六边形的数目为
考点:晶胞的计算,元素电离能、电负性的含义及应用,配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)O、S、Se位于元素周期表的同一主族,根据元素周期律,同一主族从上到下,元素电负性逐渐减小,据此判断,它们的氢化物都是分子晶体,沸点与相对分子质量有关,相对分子质量越大沸点越高,由于水分子之间有氢键,沸点较高,据此判断;
(2)根据SeO32- 中的Se原子的价层电子对数可以判断杂化方式以及离子的空间构型;
(3)锌为30号元素,最外层电子排布图为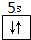 ,位于周期表的第四周期第ⅡB族,位于周期表的ds区,据此判断镉的位置;
,位于周期表的第四周期第ⅡB族,位于周期表的ds区,据此判断镉的位置;
(4)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图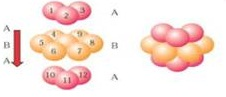 可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,根据配合物的结构特点,中心离子的提供空轨道,配体提供孤电子对,据此答题;
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,根据配合物的结构特点,中心离子的提供空轨道,配体提供孤电子对,据此答题;
(5)在石墨晶体中每个碳原子与三个正六边形相连,而每个正六边形有六个碳原子,所以每个碳原子实际占有的六边形的数目为0,5个,12g碳含有1mol碳原子,所以含有0.5mol六边形,根据ρ=
可以计算出密度.
(2)根据SeO32- 中的Se原子的价层电子对数可以判断杂化方式以及离子的空间构型;
(3)锌为30号元素,最外层电子排布图为
 ,位于周期表的第四周期第ⅡB族,位于周期表的ds区,据此判断镉的位置;
,位于周期表的第四周期第ⅡB族,位于周期表的ds区,据此判断镉的位置;(4)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图
 可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,根据配合物的结构特点,中心离子的提供空轨道,配体提供孤电子对,据此答题;
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,根据配合物的结构特点,中心离子的提供空轨道,配体提供孤电子对,据此答题;(5)在石墨晶体中每个碳原子与三个正六边形相连,而每个正六边形有六个碳原子,所以每个碳原子实际占有的六边形的数目为0,5个,12g碳含有1mol碳原子,所以含有0.5mol六边形,根据ρ=
| m |
| V |
解答:
解:(1)O、S、Se位于元素周期表的同一主族,根据元素周期律,同一主族从上到下,元素电负性逐渐减小,它们的氢化物都是分子晶体,沸点与相对分子质量有关,相对分子质量越大沸点越高,由于水分子之间有氢键,沸点较高,故答案为:Se(或硒); H2O>H2Se>H2S;
(2)根据SeO32- 中的Se原子的价层电子对数为
=4,所以硒原子的杂化方式为可以判断杂化方式为sp3,由于硒原子周围有三个氧原子,所以形成离子的空间构型为 三角锥形,故答案为:sp3; 三角锥形;
(3)锌为30号元素,最外层电子排布图为,位于周期表的第四周期第ⅡB族,位于周期表的ds区,最外层电子排布图为 ,故答案为:ds;
,故答案为:ds; ;
;
(4)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图 可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,根据配合物的结构特点,中心离子的提供空轨道,配体提供孤电子对,在这个配离子中,氨气是配体,在氨气中只有氮原子有孤电子对,所以提供孤对电子的是氮原子,故答案为:ABABAB; 12;N;
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,根据配合物的结构特点,中心离子的提供空轨道,配体提供孤电子对,在这个配离子中,氨气是配体,在氨气中只有氮原子有孤电子对,所以提供孤对电子的是氮原子,故答案为:ABABAB; 12;N;
(5)在石墨晶体中每个碳原子与三个正六边形相连,而每个正六边形有六个碳原子,所以每个碳原子实际占有的六边形的数目为0,5个,12g碳含有1mol碳原子,所以含有0.5mol六边形,在石墨晶体中,每个六棱柱含有12×
=2个碳原子,而六棱柱的体积为
a2b×10-30cm3,根据ρ=
可以计算出密度为
g/cm3=
g/cm3,故答案为:0.5NA;
.
(2)根据SeO32- 中的Se原子的价层电子对数为
| 6+2 |
| 2 |
(3)锌为30号元素,最外层电子排布图为,位于周期表的第四周期第ⅡB族,位于周期表的ds区,最外层电子排布图为
 ,故答案为:ds;
,故答案为:ds; ;
;(4)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图
 可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,根据配合物的结构特点,中心离子的提供空轨道,配体提供孤电子对,在这个配离子中,氨气是配体,在氨气中只有氮原子有孤电子对,所以提供孤对电子的是氮原子,故答案为:ABABAB; 12;N;
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,根据配合物的结构特点,中心离子的提供空轨道,配体提供孤电子对,在这个配离子中,氨气是配体,在氨气中只有氮原子有孤电子对,所以提供孤对电子的是氮原子,故答案为:ABABAB; 12;N;(5)在石墨晶体中每个碳原子与三个正六边形相连,而每个正六边形有六个碳原子,所以每个碳原子实际占有的六边形的数目为0,5个,12g碳含有1mol碳原子,所以含有0.5mol六边形,在石墨晶体中,每个六棱柱含有12×
| 1 |
| 6 |
| 3 |
| 2 |
| 3 |
| m |
| V |
| ||||
|
| 16×1030 | ||
|
| 16×1030 | ||
|
点评:本题综合性较强,主要考查了元素周期律和周期表、晶体的结构、晶胞的计算等知识,难度中等,解题时要对基础知识和基本方法熟练掌握.

练习册系列答案
相关题目
下列实验操作或装置错误的是( )
A、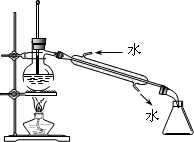 蒸馏 |
B、 过滤 |
C、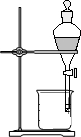 萃取 |
D、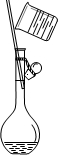 转移溶液 |
下列物质中,只含有离子键的化合物是( )
| A、KOH |
| B、NH4Cl |
| C、HCl |
| D、MgCl2 |
下列物质既能发生消去反应,又能氧化成醛的是( )
| A、苯甲醇 |
| B、2,2-二甲基-1-丙醇 |
| C、2-甲基-1-丁醇 |
| D、甲醇 |