题目内容
19.计算下列物质的微粒数或物质的量.①0.5mol H2中的氢原子数6.02×1023;
②1mol NaCl中的钠离子数6.02×1023;
③1mol H2SO4中的氢原子数.204×1024;
④1.204×1024个水分子中氢原子的物质的量4mol;
⑤9.03×1023铁原子的物质的量1.5mol.
分析 根据n=$\frac{N}{{N}_{A}}$结合物质的分子、原子构成计算该题.
解答 解:①N(H)=0.5mol×2×6.02×1023/mol=6.02×1023,故答案为:6.02×1023;
②N(Na+)=1mol×6.02×1023/mol=6.02×1023,故答案为:6.02×1023;
③N(H)=2mol×6.02×1023/mol=.204×1024,故答案为:.204×1024;
④n(H2O)=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}/mol}$=2mol,n(H)=2n(H2O)=4mol,故答案为:4mol;
⑤n(Fe)=$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}/mol}$=1.5mol,故答案为:1.5mol.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握物质的构成特点以及相关计算公式的运用,难度不大.

练习册系列答案
相关题目
7.某元素的离子带2个单位正电荷,它的核外电子排布为 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )
 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )| A. | 第二周期零族 | B. | 第三周期ⅡA族 | C. | 第二周期ⅥA族 | D. | 第三周期IIIA |
14.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图表示:下列有关判断正确的是( )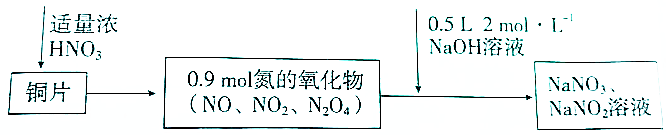

| A. | 若铜片为51.2g.则生成0.2molNaNO3 | |
| B. | 常温下,Cu遇浓硝酸发生钝化.不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16L | |
| D. | 反应过程中生成的Cu(N03)2既是氧化产物,也是还原产物 |
4.某同学学习过元素周期律、元素周期表后,为了探究同主族元素性质的递变规律,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该同学完成实验报告.
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
Ⅳ.实验结论:(3)Cl>Br>I.
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.