题目内容
14.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图表示:下列有关判断正确的是( )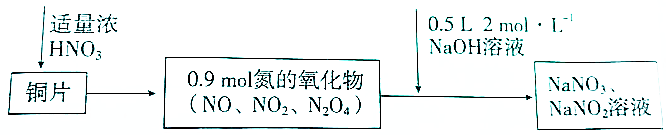
| A. | 若铜片为51.2g.则生成0.2molNaNO3 | |
| B. | 常温下,Cu遇浓硝酸发生钝化.不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16L | |
| D. | 反应过程中生成的Cu(N03)2既是氧化产物,也是还原产物 |
分析 A、n(Cu)=$\frac{51.2g}{64g/mol}$=0.8mol,n(NaOH)=0.5L×2mol/L=1mol,由终态分析法容易看出只有两种元素的价态有变化,其一是Cu→Cu(NO3)2,Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,由电子转移守恒可知,51.2gCu失去的电子等于HNO3到NaNO2得到的电子,据此计算故产物中NaNO2的物质的量,由Na守恒可知n(NaOH)=n(NaNO2)+n(NaNO3),据此计算NaNO3的物质的量;
B、常温下,金属铜遇到浓硝酸发生钝化,该反应会发生;
C、根据公式V=nVm进行计算;
D、氧化还原反应中,化合价升高元素对应产物是氧化产物,化合价降低元素对应产物是还原产物.
解答 解:A、n(Cu)=$\frac{51.2g}{64g/mol}$=0.8mol,n(NaOH)=0.5L×2mol/L=1mol,由电子守恒可知,51.2gCu失去的电子等于HNO3到NaNO2得到的电子,则0.8mol×(2-0)=n(NaNO2)×(5-3),解得n(NaNO2)=0.8mol,由Na原子守恒可知n(NaOH)=n(NaNO2)+n(NaNO3),则n(NaNO3)=1mol-0.8mol=0.2mol,故A正确;
B、常温下,Cu遇浓硝酸发生钝化,但是钝化不是不反应,可能发生上述反应,故B错误;
C、标准状况下得到的0.9mol氮氧化物的体积是0.9mol×22.4L/mol=20.16L,因为NO2和N2O4之间存在转化平衡,所以体积小于20.16,故C错误;
D、反应过程中生成的Cu(N03)2既是氧化产物,不是还原产物,故D错误.
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握硝酸的作用、N元素的化合价变化及原子守恒、电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度较大.

| A. | 1molY,1molZ | B. | 2mol X,1molY,1molN2 | ||
| C. | 1molY和3molZ | D. | 2molZ |
| A. | 物质的量之比为8:11 | B. | 密度比8:11 | ||
| C. | 体积比为11:8 | D. | 原子个数之比为11:12 |
| A. | 第ⅠA族元素都是金属元素 | |
| B. | 第ⅣA族非金属元素的单质只能形成原子晶体 | |
| C. | 第ⅥA族元素形成的单质,常温下有气、液、固三种状态 | |
| D. | 元素性质呈现周期性变化的根本原因是元素原子最外层电子数呈现周期性变化 |
| A. | 铁与稀硫酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | Al与稀H2SO4:Al+2H+→Al3++H2↑ | |
| C. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++2H2O | |
| D. | 氯化铝溶液中加氨水:Al3++3OH-→Al(OH)3↓ |
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 1:1 |
| A. | 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 | |
| B. | 生产陶瓷的主要原料是黏土 | |
| C. | 普通玻璃的主要成份只有SiO2 | |
| D. | 硅酸盐水泥以石灰石和黏土为主要原料生产 |